题目内容
20.相同温度下,已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2═HCN+NaNO2 NaNO2+HF═HCN+NaF NaNO2+HF═HNO2+NaF由此可判断下列叙述中正确的是( )| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
分析 相同温度下,酸的电离平衡常数越大,其电离程度越大,则酸性越强,较强酸能和弱酸盐反应生成弱酸,据此分析解答.
解答 解:相同温度下,酸的电离平衡常数越大,其电离程度越大,则酸性越强,较强酸能和弱酸盐反应生成弱酸,这三种酸可发生如下反应:NaCN+HNO2═HCN+NaNO2、NaNO2+HF═HCN+NaF、NaNO2+HF═HNO2+NaF,由此得出酸的强弱顺序是HF>HNO2>HCN,所以酸的电离平衡常数大小顺序是HF>HNO2>HCN,则HF的电离常数是①、HNO2的电离常数是②、HCN的电离平衡常数是③,
故选A.
点评 本题考查弱电解质的电离,侧重考查学生分析判断能力,明确弱酸酸性强弱与电离平衡常数关系即可解答,题目难度不大.

练习册系列答案
相关题目
4.下列离子组在指定溶液中能大量共存的是( )
| A. | 碱性溶液:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
8.分类法在化学学科的发展中起到了非常重要的作用.下列分类标准不合理的是( )
①根据组成元素将氧化物分成酸性氧化物和碱性氧化物
②根据在水溶液里是否完全电离将电解质分为强电解质和弱电解质
③根据是否有丁达尔现象将分散系分为溶液、胶体和浊液
④根据水溶液是否能导电将化合物分为电解质和非电解质.
①根据组成元素将氧化物分成酸性氧化物和碱性氧化物
②根据在水溶液里是否完全电离将电解质分为强电解质和弱电解质
③根据是否有丁达尔现象将分散系分为溶液、胶体和浊液
④根据水溶液是否能导电将化合物分为电解质和非电解质.
| A. | .②③ | B. | .②④ | C. | ①②③ | D. | .①③④ |
15.下列有关铝及铝合金说法错误的是( )
| A. | 氧化铝是一种高硬度、高熔沸点的化合物 | |
| B. | 铝是活泼的金属,其合金抗腐蚀能力差 | |
| C. | 铝合金具有密度小、高强度及较好的可塑性 | |
| D. | 铝合金可用于制飞机骨架等 |
5.现有bXn-和aYm+两种离子,它们的电子数相同,则a与下列式子有相等关系的是( )
| A. | b-m-n | B. | b+m-n | C. | b-m+n | D. | b+m+n |
10.化学与环境、材料、信息、能源关系密切,下列说法正确的是( )
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题 |
 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.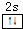 ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.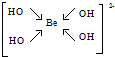 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA. 甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
