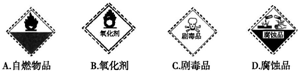
题目内容
4.下列离子组在指定溶液中能大量共存的是( )| A. | 碱性溶液:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
分析 A.Cu2+、Fe3+碱性条件下生成沉淀;
B.加入苯酚显紫色的溶液含有Fe3+,具有氧化性;
C.加入Al能放出大量H2的溶液可能为强碱性或非氧化性酸溶液;
D.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液呈碱性.
解答 解:A.碱性溶液中Cu2+、Fe3+生成沉淀,不能大量共存,故A错误;
B.加入苯酚显紫色的溶液含有Fe3+,具有氧化性,I-不能大量共存,故B错误;
C.加入Al能放出大量H2的溶液可能为强碱性或非氧化性酸溶液,碱性条件下Fe2+不能大量共存,酸性条件下Fe2+、NO3-发生氧化还原反应,故C错误;
D.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液呈碱性,离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重复分解反应及氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
14.设NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的分子数为0.4 NA | |
| B. | 标准状况下,2.24 L CCl4分子中共价键的数目为0.4NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1 NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
15.下列装置应用于实验室从废旧的含CuI/SiO2催化剂中提取碘的实验,不能达到实验目的是( )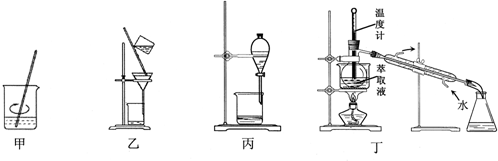

| A. | 用装置甲加稀H2SO4及H2O2氧化并用CCl4浸取 | |
| B. | 用装置乙过滤分离出浸取液 | |
| C. | 用装置丙分离得到碘的四氯化碳溶液 | |
| D. | 用装置丁分离萃取液中单质碘和四氯化碳 |
20.相同温度下,已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2═HCN+NaNO2 NaNO2+HF═HCN+NaF NaNO2+HF═HNO2+NaF由此可判断下列叙述中正确的是( )
| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.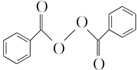 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: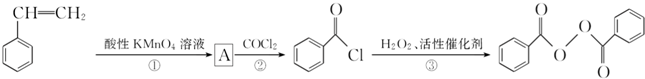
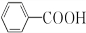 ;②的反应类型为取代反应.
;②的反应类型为取代反应.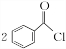 +H2O2$\stackrel{活性催化剂}{→}$
+H2O2$\stackrel{活性催化剂}{→}$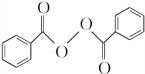 +2HCl;过氧化苯甲酰在酸性条件下水解的化学方程式为
+2HCl;过氧化苯甲酰在酸性条件下水解的化学方程式为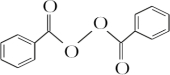 +2H2O$\stackrel{H+}{→}$
+2H2O$\stackrel{H+}{→}$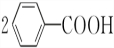 +H2O2.
+H2O2. )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称:苯甲酸乙酯.
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称:苯甲酸乙酯.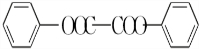 (或
(或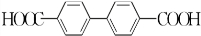 或
或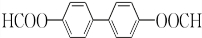 .
.
 .
.