题目内容
15.下列有关铝及铝合金说法错误的是( )| A. | 氧化铝是一种高硬度、高熔沸点的化合物 | |
| B. | 铝是活泼的金属,其合金抗腐蚀能力差 | |
| C. | 铝合金具有密度小、高强度及较好的可塑性 | |
| D. | 铝合金可用于制飞机骨架等 |
分析 A.氧化铝是离子化合物,硬度高、熔点高;
B.铝表面能形成氧化膜;
C.合金与组成它的各种成分相比,一般具有熔点低、硬度大、抗腐蚀性强等方面的特点;
D.制造分机的材料应密度小,强度大.
解答 解:A.氧化铝是离子化合物,其晶体中离子键很强,故硬度高、熔点高,故A错误;
B.铝表面能形成氧化膜,抗腐蚀能力强,故B正确;
C.铝合金属于合金中的一种,被日常生活普遍使用,具有密度小、强度高、塑性好、抗腐蚀能力强等特点,故C错误;
D.铝合金密度小,强度高适合制作飞机,故D错误.
故选B.
点评 本题考查学生合金的性质和性能、金属铝的性质和应用,注意知识的归纳和整理是关键,难度中等.

练习册系列答案
相关题目
18.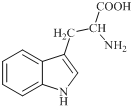 色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
 色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中.纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是( )| A. | 色氨酸的分子式为C11H12N2O2 | |
| B. | 色氨酸能发生取代、加成、酯化、中和反应 | |
| C. | 色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐 | |
| D. | 将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽 |
10.下列说法不正确的是( )
| A. | 豆科植物通过根瘤菌吸收空气中的氮是化学变化 | |
| B. | 化石燃料燃烧通常不释放出氮氧化合物 | |
| C. | 汽车尾气中排放的氮氧化合物是由游离态氮转化来的 | |
| D. | 植物秸秆燃烧时放出氮氧化合物,参与了氮的循环 |
20.相同温度下,已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2═HCN+NaNO2 NaNO2+HF═HCN+NaF NaNO2+HF═HNO2+NaF由此可判断下列叙述中正确的是( )
| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
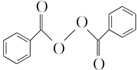 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: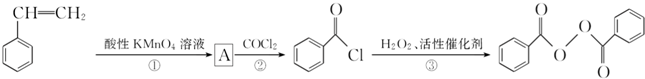
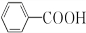 ;②的反应类型为取代反应.
;②的反应类型为取代反应.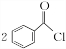 +H2O2$\stackrel{活性催化剂}{→}$
+H2O2$\stackrel{活性催化剂}{→}$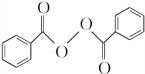 +2HCl;过氧化苯甲酰在酸性条件下水解的化学方程式为
+2HCl;过氧化苯甲酰在酸性条件下水解的化学方程式为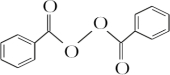 +2H2O$\stackrel{H+}{→}$
+2H2O$\stackrel{H+}{→}$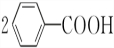 +H2O2.
+H2O2. )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称:苯甲酸乙酯.
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称:苯甲酸乙酯.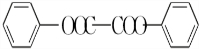 (或
(或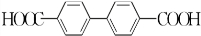 或
或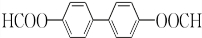 .
. .
.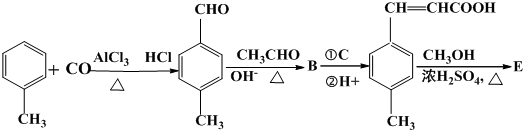
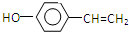 ;
;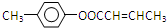 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为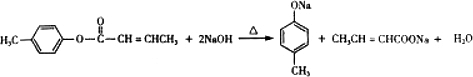 .
. .
.