题目内容
9.氮的氧化物、硫的氧化物是引起雾霾天气的主要原因之一,吸收SO2和NO,获得Na2S2O4和NH4NO3产生的如图1(Ce为铈元素)
(1)装置Ⅰ中生成HSO3-的离子方程式为SO2+OH-=HSO3-
(2)含硫个微粒(H2SO3、HSO3-和SO32-存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图甲所示

①下列说法正确的是ac(填字母序号)
a.pH=8时,溶液中c(HSO3-)<c(SO32-)
b.pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO3-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4-5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:HSO3-在溶液中存在电离平衡:HSO3-?SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式NO+H2O+Ce4+=Ce3++NO2-+2H+(4)装置Ⅲ的作用只有是再生Ce4+,其原理如图乙所示
①生成Ce4+的电极反应式为Ce3+-e-═Ce4+
②生成Ce4+从电解槽的a(填字母序号)口流出
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-2,要使1m3该溶液中的NO2-完全转化为NH4NO3,需要至少向装置Ⅳ中通入标准状况下的O2122aL(用含a代数式表示,计算结果保留整数).
分析 (1)二氧化硫是酸性氧化物,能和强碱之间发生反应;
(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,根据离子浓度大小比较的方法来回答;
②NaHSO3溶液中HSO3-的电离大于水解,溶液显示酸性,根据平衡移动原理来回答;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
(4)在电解池中,阳极上发失去电子的氧化反应,阴极上发生得电子的还原反应;
(5)根据氧化还原反应中电子守恒计算.
解答 解:(1)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,
故答案为:SO2+OH-=HSO3-;
(2)①a.当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序是:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+),c(SO32-)>c(HSO3-),故a正确;
b.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故b错误;
c.图象可知,为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右.故c正确;
故答案为:ac;
②NaHSO3溶液中HSO3-的电离大于水解,HSO3-?SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,
故答案为:HSO3-在溶液中存在电离平衡:HSO3-?SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,
故答案为:NO+H2O+Ce4+=Ce3++NO2-+2H+;
(4)①电解池的阴极发生得电子的还原反应,电极反应式为:2HSO3-+4H++4e-=S2O32-+3H2O,阳极电极反应为:Ce3+-e-═Ce4+,
故答案为:Ce3+-e-═Ce4+;
②在电解池中,阳极上是Ce3+失电子成为Ce4+的过程,所以生成Ce4+从电解槽的阳极上极a极流出,
故答案为:a;
(5)NO2-的浓度为a g•L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数目是:$\frac{1000a}{46}$mol,
设消耗标况下氧气的体积是VL,则失电子为:$\frac{V}{22.4}$mol×4=$\frac{V}{5.6}$mol,
根据电子守恒可得:$\frac{1000a}{46}$mol=$\frac{V}{5.6}$mol,
解得:V=122a,
故答案为:122a.
点评 本题考查混合物分离提纯的综合应用,为高频考点,难度中等,涉及氧化还原反应、离子浓度比较、电化学等,综合性强,侧重分析、计算能力的考查,培养了学生灵活应用基础知识的能力.

| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.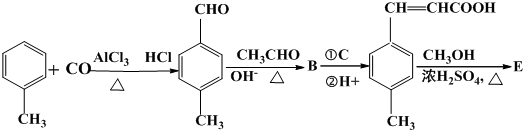
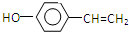 ;
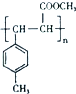
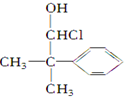
;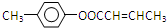 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为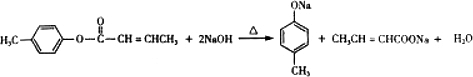 .
. .
.
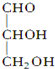
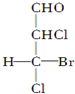

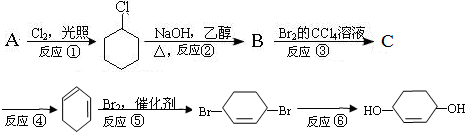
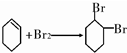
 .
.