题目内容
12.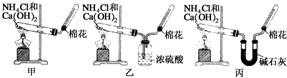 甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:(1)三位同学制取氨气的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是BD.
A.氨气难溶于水 B.氨气极易溶于水C.氨气密度比空气大 D.氨气密度比空气小
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(如果他们的实验操作都正确),你认为没有收集到氨气的同学是乙(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是2NH3+H2SO4═(NH4)2SO4(用化学方程式表示).
(4)检验氨气是否收集满的方法是C.
A.闻到有氨气逸出
B.棉花被气体冲出
C.用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
D.用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的是丙(填“甲”、“乙”或“丙”).
分析 (1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氯气和水;
(2)依据氨气极易溶于水,密度小于空气,选择收集方法;
(3)浓硫酸具有吸水性和酸性,能够做干燥剂,但是不能干燥碱性气体;氨气与硫酸反应生成硫酸铵;
(4)氨气为碱性气体,与水反应生成一水合氨,一水合氨电离生成氢氧根离子,显碱性遇到湿润的红色石蕊试纸变蓝色;
(5)碳酸氢铵分解生成氨气、二氧化碳、水,要得到纯净的氨气,应除去二氧化碳和水.
解答 解:(1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氯气和水,化学方程式:
2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,所以不能用排水法收集,只能用排气法收集,又因为其密度小于空气密度,所以选择向下排空气法;
故选:BD;
(3)氨气为碱性气体,浓硫酸具有酸性能够与氨气反应生成硫酸铵,方程式:2NH3+H2SO4═(NH4)2SO4,所以不能用浓硫酸干燥氨气,乙同学收集不到氨气;
故答案为:乙 2NH3+H2SO4═(NH4)2SO4;
(4)氨气是碱性气体,遇到遇到湿润的红色石蕊试纸变蓝色,据此可以判断氨气的存在;
故选:C;
(5)碳酸氢铵分解生成氨气、二氧化碳、水,要得到纯净的氨气,应除去二氧化碳和水,甲同学制备的氨气中含有二氧化碳和水蒸气;
乙同学用浓硫酸干燥氨气,氨气被吸收,收集不到氨气;
丙同学,用碱石灰吸收二氧化碳和水蒸气,可以收集到纯净的氨气;
故答案为:丙.
点评 本题考查了氨气的实验室制备,明确制备原理和氨气的性质是解题关键,注意氨气的收集方法的选择,题目难度不大.

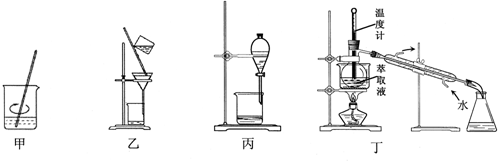
| A. | 用装置甲加稀H2SO4及H2O2氧化并用CCl4浸取 | |
| B. | 用装置乙过滤分离出浸取液 | |
| C. | 用装置丙分离得到碘的四氯化碳溶液 | |
| D. | 用装置丁分离萃取液中单质碘和四氯化碳 |
| A. | HF的电离常数是① | B. | HNO2的电离常数是① | ||
| C. | HCN的电离常数是② | D. | HNO2的电离常数是③ |
氧化还原反应:
2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3=2KSCN+CO2↑+H2O; KCN+CO2+H2O=HCN+KHCO3
热分解反应:4NaClO $\frac{\underline{\;\;△\;\;}}{\;}$ 3NaCl+NaClO4;NaClO4 $\frac{\underline{\;\;△\;\;}}{\;}$ NaCl+2O2↑
下列说法正确是( )
| A. | 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 | B. | 还原性(碱性溶液):Fe(OH)2>I2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO>NaClO4 | D. | 酸性(水溶液):H2CO3>HSCN>HCN |
 .
.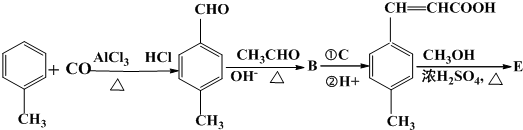
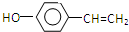 ;
;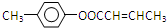 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为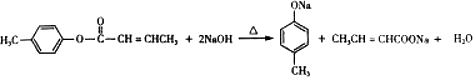 .
.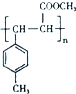 .
.