题目内容
10.已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=Q1 kJ/mol,H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=Q2 kJ/mol,
则Q1>Q2(填“>”“<”或“=”)
分析 氢气燃烧是放热反应,反应热为负值,反应物均相同,生成液态水比生成水蒸气放热多,据此分析.
解答 解:已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=Q1 kJ/mol,
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=Q2 kJ/mol,
氢气燃烧是放热反应,反应物均相同,生成物中水蒸气比液态水能量高,所以生成液态水比生成水蒸气放热多,由于Q为负值,所以Q1>Q2,
故答案为:>.
点评 本题考查了反应热大小比较,注意把握物质状态与具有能量高低的关系,题目难度不大.

练习册系列答案
相关题目
10.下列关于同主族元素的说法错误的是( )
| A. | 同主族元素随原子序数递增,元素原子的得电子能力逐渐增强 | |
| B. | 同主族元素随原子序数递增,单质氧化能力逐渐增强 | |
| C. | 同主族元素原子最外层电子数都相同 | |
| D. | 同主族元素的原子半径,随原子序数增大而逐渐增大 |
18.下列反应的离子方程式正确的是( )
| A. | 氯气通入等物质的量溴化亚铁溶液中:2Cl2+2Fe2++2 Br-=4 Cl-+2Fe3++Br2 | |
| B. | 向苯酚溶液中滴加Na2CO3溶液: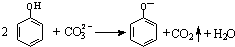 | |
| C. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O=2HCO3- | |
| D. | 氨水吸收过量的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O |
5.下列有关实验装置进行的相应实验,能达到实验目的是( )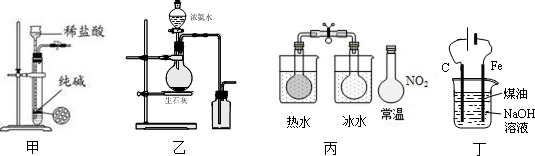

| A. | 用图甲所示装置控制制取少量纯净的CO2气体 | |
| B. | 用图乙所示装置制取并收集氨气 | |
| C. | 用图丙所示装置可以说明反应2NO2(g)?N2O4(g)是放热反应 | |
| D. | 用图丁所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
15.下列离子方程式正确的是( )
| A. | Na与水反应 Na+2H2O=Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-=Al(OH)3↓ | |
| C. | 氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 氢氧化钡溶液与硫酸溶液反应 Ba2++OH-+H++SO42-=BaSO4↓+H2O |
2.放射性同位素钬${\;}_{67}^{166}$Ho的原子核内的中子数与核外的电子数之差是( )
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
19.生活中的一些问题常涉及化学知识.下列叙述中,不正确的是( )
| A. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 人造黄油里的反式脂肪酸对健康不利,它是液态植物油加氢时产生的 | |
| D. | 新制的氢氧化铜可以检验病人是否患有糖尿病 |

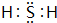 .
.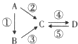 Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.
Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.