题目内容
15.下列离子方程式正确的是( )| A. | Na与水反应 Na+2H2O=Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-=Al(OH)3↓ | |
| C. | 氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 氢氧化钡溶液与硫酸溶液反应 Ba2++OH-+H++SO42-=BaSO4↓+H2O |
分析 A.电子、电荷不守恒;
B.反应生成偏铝酸钠和氢气;
C.反应生成氯化钠、次氯酸钠和水;
D.不符合离子的配比.
解答 解:A.Na与水反应的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.向AlCl3溶液中加入过量的NaOH溶液的离子反应为Al3++4OH-=AlO2-+2H2O,故B错误;
C.氯气与烧碱溶液反应的离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故C正确;
D.氢氧化钡溶液与硫酸溶液反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
6.下列叙述正确的是( )
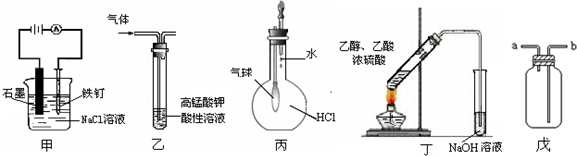
①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.

①装置甲可防止铁钉生锈
②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性
④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体.
| A. | ①⑤ | B. | ②④ | C. | ③④ | D. | ③⑤ |
20.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A. | 短周期元素形成离子后,最外层电子达到都达到8电子稳定结构 | |
| B. | 所有主族元素的正化合价数等于它的族序数 | |
| C. | 第3、4、5、6周期元素的数目分别是8、18、32、32 | |
| D. | 第4周期由左至右第8、9、10三列中没有非金属元素 |
7.下列物质中,只含有离子键的是( )
| A. | NaOH | B. | NH4Cl | C. | MgCl2 | D. | H2O |
4.将 转变为
转变为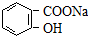 的方法为( )
的方法为( )
 转变为
转变为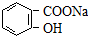 的方法为( )
的方法为( )| A. | 与稀H2SO4共热后,加入足量的NaOH | |
| B. | 加入足量的稀盐酸共热 | |
| C. | 与稀H2SO4共热后,加入足量的NaHCO3 | |
| D. | 与足量的NaOH溶液共热后,再滴加过量的盐酸 |

 .
. .
. .
. 的两步化学方程式
的两步化学方程式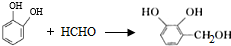 、
、 .
.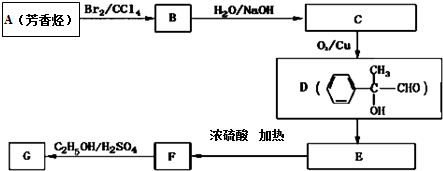
 .
.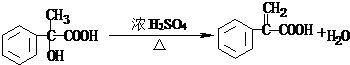 .
.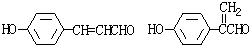 .
.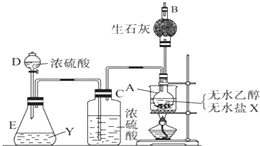 为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.
为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.