题目内容
5.下列有关实验装置进行的相应实验,能达到实验目的是( )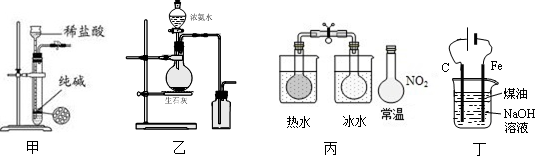
| A. | 用图甲所示装置控制制取少量纯净的CO2气体 | |
| B. | 用图乙所示装置制取并收集氨气 | |
| C. | 用图丙所示装置可以说明反应2NO2(g)?N2O4(g)是放热反应 | |
| D. | 用图丁所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
分析 A.不能排除氯化氢杂质;
B.应用向下排空法收集氨气;
C.加热时气体颜色变深,说明温度升高平衡向生成NO2的方向移动;
D.制备Fe(OH)2时Fe应为阳极.
解答 解:A.盐酸易挥发,生成的二氧化碳气体中含有氯化氢杂质,应用稀硫酸与纯碱反应,故A错误;
B.氨气密度比空气小,应用向下排空法收集氨气,故B错误;
C.NO2为红棕色气体,而N2O4无色,加热时气体颜色变深,说明温度升高平衡向生成NO2的方向移动,可以说明反应2NO2(g)?N2O4(g)是放热反应,故C正确;
D.制备Fe(OH)2时Fe应为阳极,铁被氧化,与氢氧根离子反应生成氢氧化亚铁,故D错误.
故选C.
点评 本题考查了实验方案评价,为高考常见题型,明确实验原理是解本题关键,根据物质的性质结合实验装置来分析解答,答题时注意把握实验的严密性和可行性的评价,把握实验的操作原理和方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列化学用语正确的是( )
| A. | 氯化氢的电子式: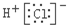 | B. | N2的结构式:N≡N | ||
| C. | 硫离子结构示意图: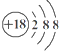 | D. | 四氯化碳的电子式: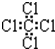 |
16.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol/L NaAlO2溶液中:H+、Na+、Cl-、SO3- | |
| B. | 无色溶液中:K+、Ca2+、Cl-、NO3- | |
| C. | 使酚酞变红色的溶液中:Na+、Cu2+、HCO3-、NO3- | |
| D. | 使石蕊变红的溶液中:H+、Na+、Fe2+、MnO4- |
13.25℃时,H2SO3?HSO${\;}_{3}^{-}$+H+的电离平衡常数Kh=1×10-2,下列说法不正确的是( )
| A. | 该温度下NaHSO3 的水解平衡常数Kh=1×10-2 | |
| B. | 若向NaHSO3 溶液中加入少量的I2,则溶液中$\frac{c{(H}_{2}{SO}_{3})}{c(HS{O}_{3}^{-})}$ 将减小 | |
| C. | 略微升高温度 Ka(H2SO3)和 Kh(NaHSO3)均增大 | |
| D. | NaHSO3溶液中:c(H+)<c(S${O}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-) |
20.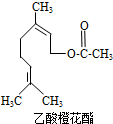 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
| A. | ①②③ | B. | ①②⑤ | C. | ①②⑤⑥ | D. | ③④⑥ |
17.对下列事实的解释不正确的是( )
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 反应CuSO4+H2S=CuS↓+H2SO4,说明硫化铜既不溶于水,也不溶于稀硫酸 | |
| C. | 常温下浓硫酸、浓硝酸可以用铝罐储存,说明浓硫酸、浓硝酸与铝不反应 | |
| D. | 漂白粉长期放置在空气中会失效,说明其主要成分与空气中的某成分发生了反应 |
14.下列有关电能特点的说法错误的是( )
| A. | 电能是现代社会应用最广泛,使用最方便,污染最小的二次能源 | |
| B. | 目前我国发电总量中火电所占比率最多 | |
| C. | 燃煤发电过程中能量转换方式为:化学能→热能→机械能→电能 | |
| D. | 火力发电过程中能量转化率很高 |