题目内容
20.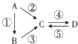 Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.
Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.(1)若B是气态氢化物,C,D是氧化物且会造成光化学烟雾污染,则A中所含元素在元素周期表中的位置为第二周期第ⅤA族;B的热稳定性比甲烷的热稳定性大(填“大”或“小”);反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(2)若D物质具有两性,反应②、③、⑤均需要强碱溶液,反应④需要通入过量的一种引起温室效应的主要气体.反应④的离子方程式为AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-.
(3)若A是当今应用最广泛的金属,反应④用到A,反应②,⑤均用到同一种非金属单质,C的溶液常用于蚀刻印刷电路板,该反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+;
Ⅱ.(1)高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点.Na2FeO4生产方法之一是隔膜电解法,其原理为Fe+2NaOH+2H2O$\frac{\underline{\;电解\;}}{\;}$Na2FeO4+3H2↑,则电解时阳极发生的电极反应式为Fe+8OH--6e-═FeO42-+4H2O,阴极区溶液的pH增大(填“增大”、“减小”或“不变”).
(2)为了测定硫酸铜晶体(CuSO4•xH2O)中的x的值,某研究小组设计了以下实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液,过滤,沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为ng,据此计算,x=$\frac{40(m-2n)}{9}$(用含m、n的代数式表示)
分析 Ⅰ.(1)若B是气态氢化物,C,D是氧化物且会造成光化学烟雾污染,则C应为NO,D为NO2,B为NH3,A是单质,则A为N2,据此答题;
(2)若D物质具有两性,含有Al元素,则A为Al,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸盐,D为Al(OH)3,②③反应均要用强碱溶液,B为氧化铝或铝盐,据此解答;
(3)若A是应用最广泛的金属,则A为Fe,④反应用到A,②⑤反应均用到同一种非金属单质,C的溶液用于蚀刻印刷铜电路板,含有铁离子,则非金属性单质为Cl2,可推知C为FeCl3,D为FeCl2
Ⅱ.(1)Na2FeO4溶液,电解时阳极发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;阴极发生还原反应,电极反应式为2H2O+2e-═H2↑+2OH-,据此解答;
(2)在实验方案中,硫酸铜与氢氧化钠反应生成氢氧化铜,再加热到质量不变得氧化铜,根据氧化铜的质量利用元素守恒可计算晶体中硫酸铜的质量,再根据晶体中硫酸铜与结晶水的质量比求得x值;
解答 解:Ⅰ.(1)若B是气态氢化物,C,D是氧化物且会造成光化学烟雾污染,则C应为NO,D为NO2,B为NH3,A是单质,则A为N2,N元素周期表中的位置为第二周期第ⅤA族,由于氮的非金属性强于碳,所以氨气的热稳定性比甲烷的热稳定性大,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:第二周期第ⅤA族;大;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)若D物质具有两性,含有Al元素,则A为Al,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸盐,D为Al(OH)3,②③反应均要用强碱溶液,B为氧化铝或铝盐,则:反应④的离子方程式为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(3)若A是应用最广泛的金属,则A为Fe,④反应用到A,②⑤反应均用到同一种非金属单质,C的溶液用于蚀刻印刷铜电路板,含有铁离子,则非金属性单质为Cl2,可推知C为FeCl3,D为FeCl2,C的溶液用于蚀刻印刷铜电路板反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,
故答案为:Cu+2Fe3+=Cu2++2Fe2+;
Ⅱ.(1)Na2FeO4溶液,电解时阳极发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;阴极发生还原反应,电极反应式为2H2O+2e-═H2↑+2OH-,所以阴极区溶液的pH会增大,
故答案为:Fe+8OH--6e-═FeO42-+4H2O;增大;
(2)在实验方案中,硫酸铜与氢氧化钠反应生成氢氧化铜,再加热到质量不变得氧化铜,根据CuSO4~Cu(OH)2~CuO,可得硫酸铜的质量为$\frac{160}{80}$ng=2ng,再根据160:18x=2n:(m-2n),得x=$\frac{40(m-2n)}{9}$,
故答案为:$\frac{40(m-2n)}{9}$.
点评 本题考查了无机物的推断,涉及Al、N、Fe元素单质化合物性质、电解原理的应用、物质组成的确定、化学计算等,需要学生熟练掌握元素化合物知识,综合性强,难度大,主要考查学生分析问题的能力,是高考的热点习题.

 阅读快车系列答案
阅读快车系列答案| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl | |
| B. | 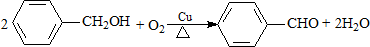 | |
| C. | 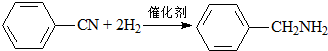 | |
| D. | 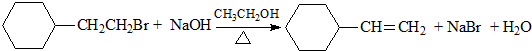 |
(1)工业冶炼铝,以石墨为阳极.阳极反应式为2O2--4e-=O2↑,可能发生副反应有C+O2$\frac{\underline{\;高温\;}}{\;}$CO2(或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO).
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为.如果理论输出电压为1.50V,能量密度E=.
(3)向75mL 4mol•L-1KOH溶液中缓慢通入4480mL CO2气体(标准状况)恰好完全被吸收.①写出该反应的离子方程式:2CO2+3OH-=CO32-+HCO3-+H2O.
②该吸收溶液中离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
③常温下,a mol•L-1KHCO3溶液的pH=8,HCO3-的水解常数约等于$\frac{10{\;}^{-12}}{a-10{\;}^{-6}}$.(用含a式表示).
(4)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1.
(5)某温度下,发生可逆反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.0kJ•mol-1
①向某容器中充入1.0molH2和1.0mol(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下列所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.
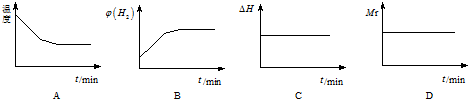
下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)
①加热条件下,过量的Mg与浓硫酸充分反应
②4molH2与1molN2在一定条件下充分反应
③在加热条件下,过量的MnO2与浓盐酸充分反应
④在加热条件下,过量的Cu与浓硫酸充分反应
⑤过量的Ag与浓硝酸充分反应
⑥过量的稀硫酸与块状石灰石反应
⑦过量的Cl2与NaBr溶液反应.
| A. | ②③④⑥ | B. | ②③⑤⑦ | C. | ①③⑤⑥ | D. | ③④⑤⑥ |
| A. | 2Q1=Q | B. | 2Q1<Q | C. | 2Q1>Q | D. | 无法判断 |
| A. | 生成40.0 L N2(标准状况) | |
| B. | 有0.250 mol KN03被氧化 | |
| C. | 转移电子的物质的量为1.25 mol | |
| D. | 被氧化的N原子的物质的量为2.5mol |
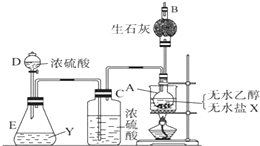 为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.
为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.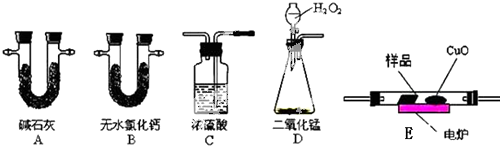
 取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答:
取4.4g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8g,B管增重3.6g.请回答: