题目内容
【题目】中华人民共和国国家标准(GB2760﹣2011)规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定.
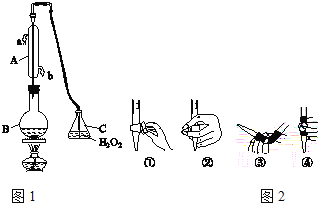
(1)仪器A的名称是_____,水通入A的进口为_____。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____。
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的_____(填数字编号);若滴定终点时溶液的pH=8.8,则选择的指示剂为_____;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10mL,②=40mL,③<10mL,④>40mL)。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:_____g/L。
【答案】冷凝管或冷凝器 b SO2+H2O2=H2SO4 ③ 酚酞 ④ 0.24
【解析】
由题中信息可知,葡萄酒中加入适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,SO2还原性较强,可以被H2O2氧化为硫酸,然后用标准NaOH溶液滴定该溶液,可以测出葡萄酒中SO2的含量。
(1)根据仪器A的结构可知其为冷凝管或冷凝器,其用于冷凝回流易挥发的液体,为提高冷凝效率,冷却水通入A的进口为下口,即b口.
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,SO2还原性较强,可以被H2O2氧化为硫酸,其化学方程式为SO2+H2O2=H2SO4.
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,标准液要装在碱式滴定管中,滴定前排气泡时,应选择图2中的③;若滴定终点时溶液的pH=8.8,溶液呈弱碱性,为了减小实验误差,故选择的指示剂为酚酞;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,由于50mL刻度下方还有一段没有刻度的管子,则管内液体的体积大于40mL,故选④项。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中n(SO2)= n(H2SO4)=0.5n(NaOH)=0.525.0010-3L0.0900mol/L=1.12510-3mol,SO2含量为![]() g/L。
g/L。

【题目】有U、V、W、X四种前三周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 外层电子数是最内层电子数的两倍 |
W | 单质中有三对共用电子对 |
X | 是地壳中含量最多的元素 |
请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子的空间构型为________。
(2)写出W单质的结构式 ___________,其化学键为________性共价键:W最简单气态氢化物的电子式为___________,分子的空间构型是___________,其化学键为___________性共价键。
(3)X在周期表中的位置是_______,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)
(4)乙和丙分别是V和X的某种氢化物,这两种氢化物分子中含有有18个电子。乙和丙的化学式分别是________、________。