题目内容
【题目】25℃时,水中存在电离平衡:H2O ![]() H++OH-△H>0。下列叙述正确的是
H++OH-△H>0。下列叙述正确的是
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
C.向水中加入少量NH4Cl固体,平衡正向移动,溶液呈碱性
D.向0.1mol/L的醋酸溶液中加入一定量醋酸钠晶体,溶液中c(OH-)增大,Kw不变
【答案】D
【解析】
A.水的电离是吸热过程,升高温度,平衡向电离方向移动,Kw增大,c(H+)增大,则pH减小,故A错误;
B.向水中加入少量固体NaOH,c(OH-)增大,平衡逆向移动,c(H+)降低,故B错误;
C.向水中加入少量固体NH4Cl,铵根离子会和氢氧根离子之间反应,c(OH-)减小,导致平衡正向移动,c(H+)增大,溶液显酸性,故C错误;
D.醋酸钠晶体会电离出CHCOO-,使电离平衡CHCOOH CHCOO-+ H+逆向移动,c(H+)降低,c(OH-)增大,但由于温度不变,Kw不变,故D正确;
故答案为D。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】除了酸以外,某些盐也能溶解沉淀。利用如表三种试剂进行实验,相关分析不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动
B.向①中加入酚酞显红色说明物质的“不溶性”是相对的
C.向①中加入③沉淀溶解,说明Mg(OH)2比NH3·H2O更难电离
D.①、③混合后发生反应:Mg(OH)2(s)+2NH4+![]() Mg2++2NH3·H2O
Mg2++2NH3·H2O
【题目】化学反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10mol/LNa2S2O3溶液与0.10mol/L 稀H2SO4反应速率的影响。反应方程式为:Na2S2O3 +H2SO4=Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | A | 10.0 | y |
③ | 0 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为____________,乙是实验需要测量的物理量,则表格中“乙”为____________,x、y、z的大小关系是____________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g)+3H2(g)=2NH3(g).
①已知:
化学键 | H-H | N≡N | N-H |
键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是________________________________________。
②若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,达到平衡时NH3浓度的范围是____________________。
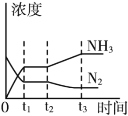
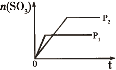
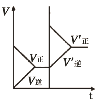
③如图表示该反应在t1时刻达到化学平衡,在t2时因改变某个条件而发生变化的情况,则t2时刻改变条件可能是__________。
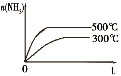
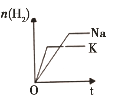
【题目】下列研究目的和示意图相符的是( )
选项 | A | B | C | D |
研究目的 | 密闭容器中,压强对反应:2SO2(g)+O2(g) | 固定容积的密闭容器中,温度对反应:N2(g)+3H2(g) | 等质量Na、K分别与足量水反应 | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应:CO(g)+H2O(g) |
示意图 |
|
|
|
|
A.AB.BC.CD.D