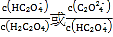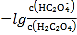题目内容
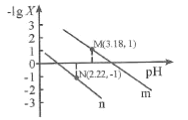
【题目】常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示。下列分析正确的是
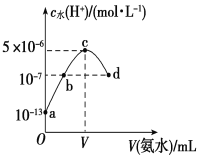
A.c点所示溶液中:c(H+)-c(OH-)=c(NH3·H2O)
B.b点所示溶液中:c(NH4+)=2 c(SO42-)
C.V=40
D.该硫酸的浓度为0.1 mol·L-1
【答案】A
【解析】
A. c点所示溶液是硫酸铵溶液,电荷守恒式为c(H+)+c(NH4+)═2c(SO42)+c(OH),物料守恒式为c(NH4+) +c(NH3.H2O)═2c(SO42),两式相减可得:c(H+)c(OH)═c(NH3.H2O),故A正确;
B. 根据电荷守恒:c(H+)+c(NH4+)═2c(SO42)+c(OH),b点为硫酸铵和硫酸的混合溶液,呈酸性,c(OH)<c(H+),所以c(NH4+)<2c(SO42),故B错误;
C. c点水电离程度最大,说明此时铵根离子浓度最大,对水的电离促进程度最大,所以两者恰好完全反应生成硫酸铵,而稀硫酸的浓度为0.05mol/L,所以氨水的体积也是20ml,即V=20,故C错误;
D. 根据20mL的稀H2SO4溶液中,水电离出的氢离子浓度是1013,根据水的离子积得到硫酸电离出的氢离子浓度是0.1mol/L,稀硫酸的浓度为0.05mol/L,故D错误;
答案选AB。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】除了酸以外,某些盐也能溶解沉淀。利用如表三种试剂进行实验,相关分析不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动
B.向①中加入酚酞显红色说明物质的“不溶性”是相对的
C.向①中加入③沉淀溶解,说明Mg(OH)2比NH3·H2O更难电离
D.①、③混合后发生反应:Mg(OH)2(s)+2NH4+![]() Mg2++2NH3·H2O
Mg2++2NH3·H2O