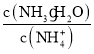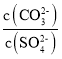题目内容
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是
2NO+O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A.①③④B.②③C.①④D.①②③④
【答案】C
【解析】
①单位时间生成nmolO2为正反应速率,生成2nmolNO2为逆反应速率,说明正逆反应速率相等,反应达平衡态;
②单位时间生成nmolO2、生成2nmolNO均为正反应速率,不能说明反应达平衡态;
③无论是否达平衡态,化学反应速率之比都等于化学反应方程式的计量系数之比,所以用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态不能说明反应达平衡态;
④混合气体的颜色不再改变,说明二氧化氮的物质的量不再随时间而改变,能说明反应达平衡态;
综上所述,①④可以说明反应达平衡态,故答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某学习小组为了探究BrO3-+5Br-+6H+![]() 3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号 离子浓度 | ① | ② | ③ | ④ | ⑤ |
c(H+)/mol·L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/mol·L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/mol·L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v/mol·L-1·s-1 | 2.4×10-8 | 4.8×0-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论正确的是
A. 反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度完全相同
B. 实验②、④,探究的是c(BrO3-)对反应速率的影响
C. 若该反应速率方程为v=kca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=1
D. 实验⑤中,v1=4.8×10-8