题目内容
【题目】![]() 、Cr3+对环境具有极强的污染性,含有
、Cr3+对环境具有极强的污染性,含有![]() 、Cr3+的工业废水常采用NaOH沉淀方法除去。
、Cr3+的工业废水常采用NaOH沉淀方法除去。
已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成![]() :Cr3++3OH
:Cr3++3OH![]() Cr(OH)3
Cr(OH)3![]()
![]() +H++H2O。②
+H++H2O。②![]() 还原产物为Cr3+。③lg3.3=0.50。
还原产物为Cr3+。③lg3.3=0.50。
请回答下列问题:
(1)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=___________。
(2)常温下,向50 mL 0.05 mol·L1的Cr2(SO4)3溶液中加入1.0 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为______。
(3)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定管装液前的操作是_______。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(4)根据2![]() +2H+
+2H+![]()
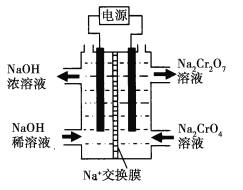
![]() +H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应为_______________。
+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应为_______________。
【答案】1.0×1032 13.5 酸式 润洗 ![]() 正 4OH4e
正 4OH4e![]() O2↑+2H2O
O2↑+2H2O
【解析】
(1)常温下,Cr3+完全沉淀(c≤1.0×10-5mol/L)时,溶液的pH为5,据此计算Cr(OH)3的溶度积常数;
(2)50mL0.05mol/L的Cr2(SO4)3溶液中加入1.0mol/L的NaOH溶液50mL,则混合后溶液中c(Cr3+)=0.05mol/L,c(OH-)=0.5mol/L,发生反应:Cr3++3OH-═Cr(OH)3,根据方程式计算;
(3)①步骤Ⅱ中所用的标准液为酸性高猛酸钾溶液,具有强氧化性,需选用酸式滴定管,滴定管装液前的操作是润洗;
②根据氧化还原反应过程电子得失守恒计算;
(4)根据装置图分析,右侧CrO4-转化为Cr2O72-,左侧NaOH稀溶液转变为NaOH浓溶液,则发生的反应应为2H2O+2e-=2OH-+H2↑,所以左侧为阴极,右侧为阳极,电解池阳极与外电源正极相连,阳极为物质失去电子,发生氧化反应,据此写出电极反应式。
(1)常温下,Cr3+完全沉淀(c≤1.0×10-5mol/L)时,溶液的pH为5,溶液中c(OH-)=10-9mol/L,c(Cr3+)=10-5mol/L,则常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=1.0×10-32,故答案为:1.0×10-32;
(2)50mL0.05mol/L的Cr2(SO4)3溶液中加入1.0mol/L的NaOH溶液50mL,则混合后溶液中c(Cr3+)=0.05mol/L,c(OH-)=0.5mol/L,发生反应:Cr3++3OH-═Cr(OH)3,则反应后c(OH-)=0.5mol/L-0.15mol/L=0.35mol/L,所以充分反应后,溶液pH=14-pOH=14+lgc(OH-)=13.5,故答案为:13.5;
(3)①步骤Ⅱ中所用的标准液为酸性高猛酸钾溶液,具有强氧化性,需选用酸式滴定管,滴定管装液前的操作是润洗,故答案为:酸式;润洗;
②cmol/L的标准KMnO4酸性溶液滴定bmL一定浓度的FeSO4溶液,消耗KMnO4溶液bmL,Mn从+7价降为+2价,Fe从+2价升为+3价,根据电子得失守恒,存在反应关系:MnO4~5Fe2+,则滴定所用的FeSO4的浓度为c(Fe2+)=5cmol/L,取bmL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗dmLFeSO4溶液,Cr从+6价降为+3价,Fe从+2价升为+3价,根据电子得失守恒,存在反应关系:Cr2O72-~6Fe2+,则bmL溶液中Na2Cr2O7的含量为![]() =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L;
mol/L;
(4)根据装置图分析,右侧CrO4-转化为Cr2O72-,左侧NaOH稀溶液转变为NaOH浓溶液,则发生的反应应为2H2O+2e-=2OH-+H2↑,所以左侧为阴极,右侧为阳极,电解池阳极与外电源正极相连,阳极为物质失去电子,发生氧化反应,则其电极反应为:4OH--4e-═O2↑+2H2O,故答案为:正;4OH--4e-═O2↑+2H2O。

【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
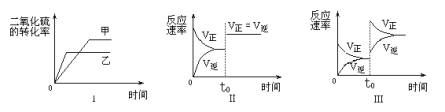
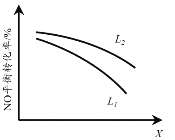
②L、X可分别代表压强或温度。下图表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______。
II.柴油燃油车是通过尿素-选择性催化还原(Urea-SCR)法处理氮氧化物。
Urea-SCR的工作原理为:尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生 NH3,生成的NH3与富氧尾气混合后,加入适合的催化剂,使氮氧化物得以处理。
(3)尿素水解的化学方程式是______。
(4)下图为在不同投料比[n(尿素)/n(NO)]时NO转化效率随温度变化的曲线。
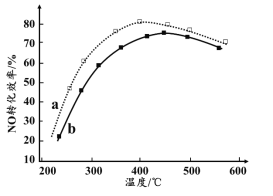
① 尿素与NO物质的量比a______b(填“>”、“=”或“<”)
② 由图可知,温度升高,NO转化效率升高,原因是______。温度过高,NO转化效率下降,NO的浓度反而升高,可能的原因是______(写出一种即可)。
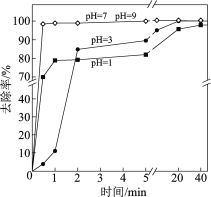
【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如下。
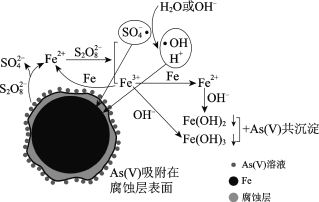
零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型
资料:
Ⅰ.酸性条件下SO4·为主要的自由基,中性及弱碱性条件下SO4·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
① 砷在元素周期表中的位置是______。
② 砷酸的化学式是______,其酸性比H3PO4______(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O82反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①S2O82中S的化合价是______。
②零价铁与过硫酸钠反应的离子方程式是______。
③Fe3+转化为Fe2+的离子方程式是______。
(3)不同pH对As(Ⅴ)去除率的影响如图。5 min内pH = 7和pH = 9时去除率高的原因是______。