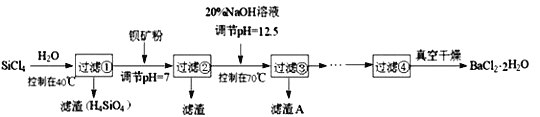
��Ŀ����
����Ŀ��RLClaisen˫�����Ϸ�Ӧ�Ļ������£�2RCH2COOC2H5![]()
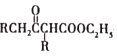 +C2H5OH�����ø÷�Ӧ�Ʊ�������K��һ�ֺϳ�·����ͼ
+C2H5OH�����ø÷�Ӧ�Ʊ�������K��һ�ֺϳ�·����ͼ
�Իش��������⣺
��1��A�������ӳ����÷�����������Ϊ______��A��B�ķ�Ӧ������______��D�к��������ŵ�������______��
��2��C�Ľṹ��ʽΪ______��F��G�ķ�Ӧ������G�⣬�����ɵ�����Ϊ______��
��3��H��K��Ӧ�Ļ�ѧ����ʽΪ______��
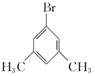
��4�����б����ṹ��B��ͬ���칹����______�֣�B�������⣩�����к˴Ź���������ʾ3���Ľṹ��ʽΪ______����дһ�ּ��ɣ���
��5����������������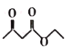 ����һ����Ҫ���л��ϳ�ԭ�ϣ�д�����Ҵ��Ʊ���ϴ�����ҕr�ĺϳ�·�ߣ����Լ���ѡ����______��
����һ����Ҫ���л��ϳ�ԭ�ϣ�д�����Ҵ��Ʊ���ϴ�����ҕr�ĺϳ�·�ߣ����Լ���ѡ����______��
���𰸡��ұ� �ӳɷ�Ӧ ȩ�� ![]() C2H5OH
C2H5OH 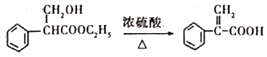 +C2H5OH 13
+C2H5OH 13 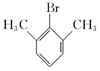 ��
�� C2H5OH
C2H5OH ![]()
��������
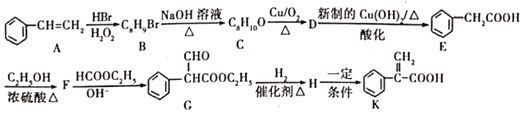
�Ա�A��E�Ľṹ����Ϸ�Ӧ������B��C�ķ���ʽ��![]() ��HBr�����ӳɷ�Ӧ����BΪ
��HBr�����ӳɷ�Ӧ����BΪ![]() ��B����ˮ�ⷴӦ��Ӧ����CΪ
��B����ˮ�ⷴӦ��Ӧ����CΪ![]() ��C��������������DΪ
��C��������������DΪ![]() ��D����������Ӧ����E��E���Ҵ�����������Ӧ����FΪ
��D����������Ӧ����E��E���Ҵ�����������Ӧ����FΪ![]() ��F�������������ȡ����Ӧ����G����Ӧͬʱ�����Ҵ���G�����������ӳɷ�Ӧ����H��H����������ȥ��Ӧ������ˮ�ⷴӦ�õ�K����HΪ
��F�������������ȡ����Ӧ����G����Ӧͬʱ�����Ҵ���G�����������ӳɷ�Ӧ����H��H����������ȥ��Ӧ������ˮ�ⷴӦ�õ�K����HΪ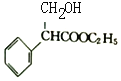 ��
��
��1��![]() �����������ӳɷ�Ӧ���ɵķ�����Ϊ
�����������ӳɷ�Ӧ���ɵķ�����Ϊ![]() �����÷�����������Ϊ���ұ���A��B�ķ�Ӧ�����ǣ��ӳɷ�Ӧ��DΪ
�����÷�����������Ϊ���ұ���A��B�ķ�Ӧ�����ǣ��ӳɷ�Ӧ��DΪ![]() ��D�к��������ŵ������ǣ�ȩ�����ʴ�Ϊ���ұ����ӳɷ�Ӧ��ȩ����
��D�к��������ŵ������ǣ�ȩ�����ʴ�Ϊ���ұ����ӳɷ�Ӧ��ȩ����
��2���ɷ�����֪��C�Ľṹ��ʽΪ![]() ��F��G�ķ�Ӧ������G�⣬�����ɵ�����Ϊ��C2H5OH���ʴ�Ϊ��
��F��G�ķ�Ӧ������G�⣬�����ɵ�����Ϊ��C2H5OH���ʴ�Ϊ��![]() ��C2H5OH��
��C2H5OH��
��3��H��K��Ӧ�Ļ�ѧ����ʽΪ��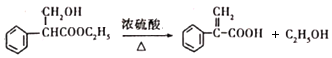 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��4��BΪ![]() ��B��ͬ���칹�庬�б�������1��ȡ����������Ϊ-CHBrCH3����2��ȡ����Ϊ-Br��-CH2CH3��-CH2Br��-CH3�������ڡ��䡢��3��λ�ýṹ����2��3=6�֣���3��ȡ����Ϊ-Br��-CH3��-CH3��2�������ڡ��䡢��3��λ�ã���Ӧ��-Br�ֱ���2�֡�3�֡�1��λ�ã���6�֣��ʷ��������Ĺ���1+6+6=13�֣����к˴Ź���������ʾ3���Ľṹ��ʽΪ
��B��ͬ���칹�庬�б�������1��ȡ����������Ϊ-CHBrCH3����2��ȡ����Ϊ-Br��-CH2CH3��-CH2Br��-CH3�������ڡ��䡢��3��λ�ýṹ����2��3=6�֣���3��ȡ����Ϊ-Br��-CH3��-CH3��2�������ڡ��䡢��3��λ�ã���Ӧ��-Br�ֱ���2�֡�3�֡�1��λ�ã���6�֣��ʷ��������Ĺ���1+6+6=13�֣����к˴Ź���������ʾ3���Ľṹ��ʽΪ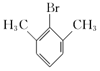 ��
��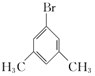 ���ʴ�Ϊ��13��
���ʴ�Ϊ��13�� ��
��
��5�����Ҵ��Ʊ����������������Ҵ��������������ᣬ������Ҵ�����������Ӧ�����������������������ڼ��������·�����Ϣ�е�ת���ɵ�����������������ϳ�·��Ϊ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

����Ŀ���������ŷŵ���Ⱦ����Ҫ��̼�⻯���һ����̼�͵�������ȡ�
I������ȼ�ͳ��ϰ�װ��Ԫ��ת����������Ч��������β����Ⱦ��
��1����֪��C(s)+O2(g) == CO2(g) ��H1 �� 393.5kJ��mol1
2C(s)+O2(g) == 2CO(g) ��H2 �� 221.0 kJ��mol1
N2(g)+O2(g) == 2NO(g) ��H 3 �� +180.5 kJ��mol1
CO��NO����β���ڴ�������������N2(g)���Ȼ�ѧ����ʽ��______��
��2���о�CO��NO�Ĵ���Ӧ�������崫���������ij�¶��¡�һ��������ܱ������У���ͬʱ��NO��COŨ�����±���
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol��L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol��L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
��ǰ4 s�ڵ�ƽ����Ӧ������(CO) ��______mol��L1��s1��
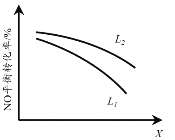
��L��X�ɷֱ����ѹǿ���¶ȡ���ͼ��ʾLһ��ʱ��NO(g)��ƽ��ת������X�ı仯��ϵ��X��������������______���ж�L1��L2�Ĵ�С��ϵ�����������ɣ�______��
II������ȼ�ͳ���ͨ������-ѡ���Դ���ԭ��Urea-SCR���������������
Urea-SCR�Ĺ���ԭ��Ϊ������[CO(NH2)2]ˮ��Һͨ�����������������У����¶ȸ���160��ʱ����ˮ�⣬���� NH3�����ɵ�NH3�븻��β����Ϻ����ʺϵĴ�����ʹ����������Դ�����
��3������ˮ��Ļ�ѧ����ʽ��______��
��4����ͼΪ�ڲ�ͬͶ�ϱ�[n(����)/n(NO)]ʱNOת��Ч�����¶ȱ仯�����ߡ�
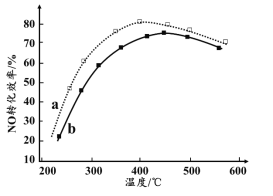
�� ������NO���ʵ�����a______b���>������=����<����
�� ��ͼ��֪���¶����ߣ�NOת��Ч�����ߣ�ԭ����______���¶ȹ��ߣ�NOת��Ч���½���NO��Ũ�ȷ������ߣ����ܵ�ԭ����______��д��һ�ּ��ɣ���