题目内容
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图转化关系(其他产物已略去),下列说法错误的是( )
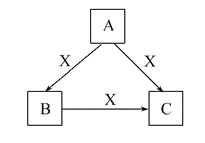
A. 若X为Cl2,则C可能为FeCl3
B. 若X为KOH溶液,则A可能为AlCl3
C. 若X为O2,则A可能为硫化氢
D. 若A、B、C均为焰色反应呈黄色的化合物,则X可能为CO2
【答案】A
【解析】试题分析:A、Fe与Cl2反应只会生成FeCl3,不会生成FeCl2,A错误;B、若X为KOH溶液,则A可为AlCl3,B、C两物质分别是Al(OH)3、KAlO2时满足转化关系,B正确;C、若X为O2,则A可以是碳, B是CO2,C是CO,C正确;D、A、B、C三物质分别是NaOH、Na2CO3、NaHCO3时满足转化关系,D正确,答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】查阅文献:Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价氮的化合物。
Ⅱ.FeSO4 + NO![]() Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被酸性KMnO4溶液氧化吸收。
甲按照如图所示的实验装置进行实验:
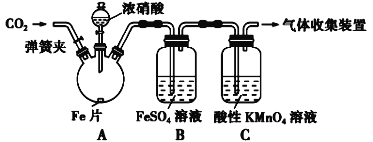
实验操作和现象记录如表所示:
实验操作 | 实验现象 |
打开弹簧夹,通入一段时间CO2,关闭弹簧夹 | |
打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞 | 无明显现象 |
加热烧瓶,反应开始后停止加热 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余 |
请回答下列问题:
① 加热前,向烧瓶中滴入浓硝酸没有明显现象的原因是________________________________
② 检验是否生成-3价氮的化合物,应进行的实验操作是________________________________
③ 甲取少量B中溶液,加热,实验现象是____________________________________________,请用化学平衡原理解释原因________________________________________________________,甲依据该现象得出结论:铁与硝酸反应有NO生成。
④乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是____________________________,证明有NO生成的实验现象是________________________________________________