题目内容
15.下列说法不正确的是( )| A. | 无论乙烯与丙烯酸以何种比例混合,只要二者总物质的量是个定值,完全燃烧时所消耗的氧气也一定是个定值 | |
| B. | 鉴别甲苯、苯乙烯、苯酚、丙烯酸溶液可选用KMnO4溶液、溴水 | |
| C. | 苯中的少量苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 | |
| D. | 苯酚的酸性很弱,但可以和Na2CO3反应 |
分析 A、各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值,则1mol各组分消耗氧气的物质的量相等;
B、甲苯、苯乙烯、苯酚、丙烯酸溶液都能够使KMnO4溶液褪色;
C、三溴苯酚能够溶于苯;
D、苯酚的酸性强于碳酸氢根离子.
解答 解:A、C2H5COOH可以改写为C3•3H2O,故1mol的CH2=CH2、C2H5COOH消耗氧气都是3mol,消耗氧气相等,故A正确;
B、甲苯、苯乙烯、苯酚、丙烯酸溶液都能够使KMnO4溶液褪色,苯乙烯、丙烯酸溶液都能够使溴水褪色,无法鉴别,故B错误;
C、三溴苯酚能够溶于苯,无法除掉,故C错误;
D、苯酚的酸性强于碳酸氢根离子,所以苯酚能够与碳酸钠溶液反应生成苯酚钠和碳酸氢钠,故D正确;
故选BC.
点评 本题考查了有机物燃烧耗氧量的计算、有机物的鉴别、苯酚的酸性、相似相溶,注意三溴苯酚能够溶于苯,题目难度不大.

练习册系列答案
相关题目
5.氮氧化物是大气污染物之一,消除氮氧化物的方法有多种.
(1)利用甲烷催化还原氮氧化物.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
则CH4将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
(2)利用NH3催化还原氮氧化物的技术叫SCR技术,该技术是目前应用最广泛的烟气氮氧化物脱除技术.反应的化学方程式为2NH3(g)+NO(g)+NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+3H2O(g)△H<0.为提高氮氧化物的转化率可采取的措施是增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(写出一条即可).
(3)利用ClO2氧化氮氧化物,其转化流程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na2SO3}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;若生成11.2LN2(标准状况),则消耗ClO267.5g.
(4)用活性碳还原法处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g)△H,某研究小组向某密闭容器内加入一定量的活性碳和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度下:
①T3℃时,该反应的平衡常数K=0.56(保留两位小数).
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减少CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“<”或“=”).
(1)利用甲烷催化还原氮氧化物.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
则CH4将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
(2)利用NH3催化还原氮氧化物的技术叫SCR技术,该技术是目前应用最广泛的烟气氮氧化物脱除技术.反应的化学方程式为2NH3(g)+NO(g)+NO2(g)$\frac{\underline{\;催化剂\;}}{\;}$2N2(g)+3H2O(g)△H<0.为提高氮氧化物的转化率可采取的措施是增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等(写出一条即可).
(3)利用ClO2氧化氮氧化物,其转化流程如下:NO$→_{反应Ⅰ}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na2SO3}$N2.已知反应Ⅰ的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,则反应Ⅱ的化学方程式是2NO2+4Na2SO3═N2+4Na2SO4;若生成11.2LN2(标准状况),则消耗ClO267.5g.
(4)用活性碳还原法处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g)△H,某研究小组向某密闭容器内加入一定量的活性碳和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度下:
| 浓度/mol.L-1 | NO | N2 | CO2 |
| 时间/min | |||
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.30 | 0.030 |
| 30 | 0.040 | 0.30 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减少CO2浓度.
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“<”或“=”).
3.下列各种气体中,其中易液化,遇挥发性酸时冒白烟,而且适宜作致冷剂的是( )
| A. | N2 | B. | NO | C. | NH3 | D. | NO2? |
10.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性 X>Y | |
| B. | Y单质与Z的最高价氧化物对应的水化物反应可制备氢气 | |
| C. | Y的最高价氧化物对应的水化物能溶于氢氧化钠 | |
| D. | 一定条件下,Z单质与W的常见单质直接生成ZW2 |
20.(A)下列各种叙述中正确的是( )
| A. | 在CH2=CH2分子中,存在五个s-sp2σ键和一个π键 | |
| B. | N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N | |
| C. | 酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3 | |
| D. | 在共价化合物中,一定存在极性共价键,可能存在非极性共价键,一定不存在离子键 |
4.氨是重要的化工原料,可以制尿素等多种产品.
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如图1所示.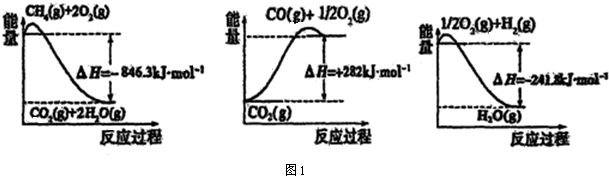
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料气中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K为2500L2•mol-2.
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出c(NH3)随时间(t)变化的曲线如图2所示,若A、B分别为不同温度时测定的曲线,则A(填“A”或“B”)曲线所对应的实验温度高,判断的依据是A曲线起始浓度小,但在20min时间内反应速率快,说明其温度高.
(5)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液,
①该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c(OH-)>c(H+),溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A、c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B、c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C、c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D、c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)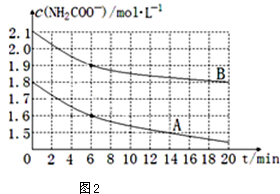
(1)合成氨所用的氢气可以甲烷为原料制得,有关化学反应的能量变化如图1所示.

CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合亚铜溶液来吸收原料气中CO,其反应原理为:
[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0
吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K为2500L2•mol-2.
(4)取两个相同的恒容容器,保持相同温度,并加入等量的CO2气体,根据实验数据绘制出c(NH3)随时间(t)变化的曲线如图2所示,若A、B分别为不同温度时测定的曲线,则A(填“A”或“B”)曲线所对应的实验温度高,判断的依据是A曲线起始浓度小,但在20min时间内反应速率快,说明其温度高.
(5)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
①该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c(OH-)>c(H+),溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A、c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B、c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C、c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D、c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)

5.下列关于铵盐的叙述中正确的是( )
| A. | 都是离子化合物 | B. | 受热都能分解出氨气 | ||
| C. | 都易溶于水 | D. | 都可以与碱反应放出氨气 |