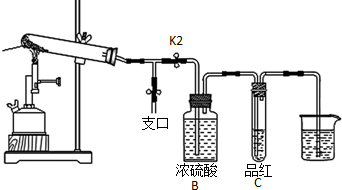
��Ŀ����
9��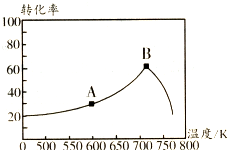 ̼��������������������Ĵ�������������������о����ȵ����⣮��������β���е�NO��CO�������ڼ���PM2.5���ŷţ���֪������Ϣ��
̼��������������������Ĵ�������������������о����ȵ����⣮��������β���е�NO��CO�������ڼ���PM2.5���ŷţ���֪������Ϣ��2CO��g��+2NO��g��?2CO2��g��+N2��g����H=-748kJ•mol-1
2CO��g��+O2��g���T2CO2��g����H2=-565kJ•mol-1
��1����һ��������N2��O2��ת��ΪNO���壬д����Ӧ���Ȼ�ѧ����ʽN2��g��+O2��g���T2NO��g����H=+183KJ/mol��
��2��Ϊ�о���ͬ�����Է�Ӧ��Ӱ�죬�ں��������£���2L�����ܱ������м���0.2mol NO��0.4mol CO���ڴ������ڵ������·�����Ӧ��10minʱ��Ӧ�ﵽƽ�⣬���10min��v��NO��=7.5��10-3mol•L-1•min-1����ƽ���n��CO��=0.25mol�����ڸ�ƽ�������˵����ȷ����bce��
a������ѹǿ��ƽ��һ�������ƶ�
b�������������䣬�����¶ȣ���ѧ��Ӧ����һ������
c�������������䣬����Ϊ�ں�ѹ�����н��У�CO��ƽ��ת���ʱȺ��������´�
d����ƽ�����������ٳ���0.2mol NO��0.1mol CO����ѧƽ�ⳣ������
e���ﵽƽ���v����NO��=2v����N2��
��3������������ͬ��tminʱ��ͬ�¶��²��NO��ת������ͼ��ʾ��A��ķ�Ӧ����v����v�����������������=������A��B���㷴Ӧ��ƽ�ⳣ���ϴ����A���A����B������
��4����ͬ�¶��µ�Ũ�ȵ�NH4NO3��NH4NO2������Һ�����NH4NO2��Һ��c��NH4+����С���Է���ԭ��
NO2-ˮ���Լ��ԣ���笠�����ˮ���ٽ����ã�0.1mol•L-1NH4NO3��Һ������Ũ���ɴ�С��˳����c��NO3-����c��NH4+����c��H+����c��OH-����������NO2-ˮ�ⷴӦ��ƽ�ⳣ��Kh=1.4��10-11mol•L-1��������λ��Ч���֣���
����֪�ĵ��볣��Ka=7.1��10-4mol•L-1��NH3•H2O�ĵ��볣��=1.7��10-5mol•L-1��
���� ��1�������Ȼ�ѧ����ʽ��˹���ɼ���õ�N2��O2��ת��ΪNO������Ȼ�ѧ����ʽ��
��2����ϻ�ѧƽ������ʽ��ʽ���㣬���10min��v��NO��=7.5��10-3mol•L-1•min-1����Ӧ�������ʵ���=
7.5��10-3mol•L-1•min-1��10min��2L=0.15mol
2CO��g��+2NO��g��?2CO2��g��+N2��g��
��ʼ����mol�� 0.4 0.2 0 0
�仯����mol�� 0.15 0.15 0.15 0.075
ƽ������mol�� 0.25 0.05 0.15 0.075
��Ӧ�����������С�ķ��ȷ�Ӧ�����ݻ�ѧƽ���ƶ�ԭ����Ӱ�����ط����жϣ�
a����Ӧ�����������С�ķ�Ӧ������ѹǿ��ƽ�������ƶ�����ͬʱ�ı��¶Ȼ�Ũ�ȣ�ƽ�����������У�
b����Ӧ�Ƿ��ȷ�Ӧ�������������䣬�����¶ȣ�ƽ��������У�����ѧ��Ӧ����һ������
c�������������䣬����Ϊ�ں�ѹ�����н��У�ѹǿ�Ⱥ��������д�ƽ��������У�CO��ƽ��ת���ʱȺ��������´�
d����ѧƽ�ⳣ��ֻ���¶ȱ仯��
e����Ӧ��֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�Ϊ����Ӧ����֮�ȣ�v����NO��=2v����N2��˵���������淴Ӧ������ͬ��
��3����ѧ��Ӧ�������¶���������NO��ת�������¶���������B����С��˵����Ӧ�Ƿ��ȷ�Ӧƽ��������У�ƽ�ⳣ����С��
��4����ͬ�¶��µ�Ũ�ȵ�NH4NO3��NH4NO2������Һ�����NH4NO2��Һ��c��NH4+����С����ΪNO2-������������ˮ���Լ��ԣ�笠�����ˮ�������ԣ�����ˮ����ٽ����������Һ��笠�����ˮ�������ԣ�����ˮ��ƽ�ⳣ������ʽ�����Ӻͷ�ĸ������������Ũ�ȵõ�ˮ��ƽ�ⳣ��Kh=$\frac{Kw}{Ka}$��
��� �⣺��1����2CO��g��+2NO��g��?2CO2��g��+N2��g����H=-748kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H2=-565kJ•mol-1
��һ��������N2��O2��ת��ΪNO���壬��Ӧ���Ȼ�ѧ����ʽ���ݸ�˹���ɼ����-�ٵõ���N2��g��+O2��g���T2NO��g����H=+183KJ/mol��
�ʴ�Ϊ��N2��g��+O2��g���T2NO��g����H=+183KJ/mol��
��2����ϻ�ѧƽ������ʽ��ʽ���㣬���10min��v��NO��=7.5��10-3mol•L-1•min-1����Ӧ�������ʵ���=
7.5��10-3mol•L-1•min-1��10min��2L=0.15mol
2CO��g��+2NO��g��?2CO2��g��+N2��g��
��ʼ����mol�� 0.4 0.2 0 0
�仯����mol�� 0.15 0.15 0.15 0.075
ƽ������mol�� 0.25 0.05 0.15 0.075
��Ӧ�����������С�ķ��ȷ�Ӧ�����ݻ�ѧƽ���ƶ�ԭ����Ӱ�����ط����жϣ�
a���ı�ѹǿ��ͬʱ�ı��¶Ȼ�Ũ�ȣ�ƽ�����������У���Ӧ�����������С�ķ�Ӧ��������������������ʱ����ѹǿ��ƽ��һ�������ƶ�����a����
b����Ӧ�Ƿ��ȷ�Ӧ�������������䣬�����¶ȣ�ƽ�������ȷ�Ӧ������У���������У�����ѧ��Ӧ����һ������b��ȷ��
c�������������䣬����Ϊ�ں�ѹ�����н��У���ѹ�������淴Ӧ����ѹǿ�Ⱥ��������д�ƽ��������У�CO��ƽ��ת���ʱȺ��������´�c��ȷ��
d����ѧƽ�ⳣ��ֻ���¶ȱ仯������Ũ�ȱ仯����d����
e����Ӧ��֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�Ϊ����Ӧ����֮�ȣ�v����NO��=2v����N2��˵���������淴Ӧ������ͬ����Ӧ���ƻ�״̬����e��ȷ��
�ʴ�Ϊ��bce��
��3����ѧ��Ӧ�������¶�����������VA��VB��NO��ת�������¶���������B����С��˵����Ӧ�Ƿ��ȷ�Ӧƽ��������У�ƽ�ⳣ����С��
�ʴ�Ϊ������A��
��4����ͬ�¶��µ�Ũ�ȵ�NH4NO3��NH4NO2������Һ�����NH4NO2��Һ��c��NH4+����С������ΪNO2-������������ˮ���Լ��ԣ�笠�����ˮ�������ԣ�����ˮ����ٽ����������Һ��笠�����ˮ�������ԣ���Һ������Ũ�ȴ�СΪ��c��NO3-����c��NH4+����c��H+����c��OH-����
����NO2-+H2O?HNO2+OH-��ˮ��ƽ�ⳣ������ʽKh=$\frac{c��O{H}^{-}��c��HN{O}_{2}��}{c��N{{O}_{2}}^{-}��}$�����Ӻͷ�ĸ������������Ũ�ȵõ�ˮ��ƽ�ⳣ��Kh=$\frac{c��O{H}^{-}��c��HN{O}_{2}��}{c��N{{O}_{2}}^{-}��}$��$\frac{c��{H}^{+}��}{c��{H}^{+}��}$=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{7.1��1{0}^{-4}}$=1.4��10-11��
�ʴ�Ϊ��NO2-ˮ���Լ��ԣ���笠�����ˮ���ٽ����ã�c��NO3-����c��NH4+����c��H+����c��OH-����1.4��10-11��
���� ���⿼�����Ȼ�ѧ����ʽ��д��������ѧƽ��Ӱ�����ط����жϣ�ƽ�ⳣ������Ӧ���ʸ���ļ���Ӧ�ã�ע������ˮ���������ʵ���ƽ��ļ�����������ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | CH4��C2H4 | B�� | CH4��C3H6 | C�� | C2H4��C3H4 | D�� | C2H2��C3H6 |
| A�� | ��CH2=CH2�����У��������s-sp2�Ҽ���һ���м� | |
| B�� | N��O��F�縺�Դ�С��F��O��N����һ�����ܴ�С��F��O��N | |
| C�� | ����ǿ����H2SO4��H2SO3��H2SeO3���ҽ��������Ⱥ�˳��SiO2��MgSiO3��CaSiO3 | |
| D�� | �ڹ��ۻ������У�һ�����ڼ��Թ��ۼ������ܴ��ڷǼ��Թ��ۼ���һ�����������Ӽ� |
| A�� | ú��ʯ�͡���Ȼ�����ǻ�ʯ��Դ | |
| B�� | ���ܡ����ܶ�������Ⱦ�Ŀ�������Դ | |
| C�� | �����ǿ�������Դ | |
| D�� | ��ʯ��Դ�Ƿ�������Դ |
��1���ϳɰ����õ��������Լ���Ϊԭ���Ƶã��йػ�ѧ��Ӧ�������仯��ͼ1��ʾ��
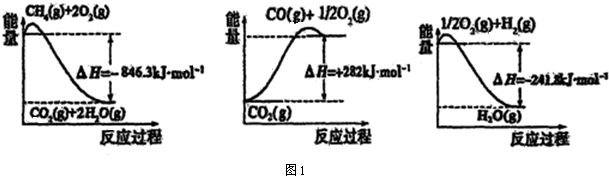
CH4��g����H2O��g����Ӧ����CO��g����H2��g�����Ȼ�ѧ����ʽΪ��CH4��g��+H2O��g��=CO��g��+3H2 ��g����H=+161.1kJ•mol-1��
��2��CO�Ժϳɰ��Ĵ����ж������ã����������������ͭ��Һ������ԭ������CO���䷴Ӧԭ��Ϊ��
[Cu��NH3��2CH3COO]��l��+CO��g��+NH3��g��?[Cu��NH3��3]CH3COO•CO��l������H��0
����CO�������ͭ��Һ�����ʵ��������ֿ��������ָ�������CO�������Թ�ѭ��ʹ�ã�����������������B������дѡ���ţ�
A�����¡���ѹ�� ��B�����¡���ѹ���� C�����¡���ѹ��������D�����¡���ѹ
��3��������ȡ����[CO��NH2��2]�ķ�ӦΪ��2NH3��g��+CO2��g��?CO��NH2��2��1��+H2O��g����H��0��ij�¶��£����ݻ�Ϊ100L���ܱ�������ͨ��4molNH3��2molCO2���÷�Ӧ���е�40sʱ�ﵽƽ�⣬��ʱCO2��ת����Ϊ50%�����¶��´˷�Ӧƽ�ⳣ��KΪ2500L2•mol-2��
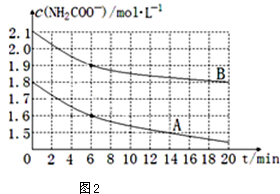
��4��ȡ������ͬ�ĺ���������������ͬ�¶ȣ������������CO2���壬����ʵ�����ݻ��Ƴ�c��NH3����ʱ�䣨t���仯��������ͼ2��ʾ����A��B�ֱ�Ϊ��ͬ�¶�ʱ�ⶨ�����ߣ���A���A����B������������Ӧ��ʵ���¶ȸߣ��жϵ�������A������ʼŨ��С������20minʱ���ڷ�Ӧ���ʿ죬˵�����¶ȸߣ�
��5����֪ijЩ���������ˮ�еĵ���ƽ�ⳣ����25�棩���±���
| ������� | H2CO3 | NH3•H2O |
| ����ƽ�ⳣ�� | Ka1=4.30��10-7��������Ka2=5.61��10-11 | Kb=1.77��10-5 |
�ٸ���Һ�ʼ��ԣ���ᡱ�����С����������ԭ��������NH3•H2O�ĵ���ƽ�ⳣ������HCO3-�ĵ���ƽ�ⳣ�������CO32-ˮ��̶ȴ���NH4+ˮ��̶ȣ���Һ��c��OH-����c��H+������Һ�ʼ��ԣ�
�ڸã�NH4��2CO3��Һ�и���Ũ��֮��Ĺ�ϵʽ����ȷ����B����
A��c��NH4+����c��CO32-����c��HCO3-����c��NH3•H2O��
B��c��NH4+��+c��H+��=c��HCO3-��+c��OH-��+c��CO32-��
C��c��CO32-��+c��HCO3-��+c��H2CO3��=0.1mol•L-1
D��c��NH4+��+c��NH3•H2O��=2c��CO32-��+2c��HCO3-��+2c��H2CO3��
| A�� | ��������������ȡ����Ӧ | B�� | ��ϩ�����������ӳɷ�Ӧ | ||
| C�� | ��ϩ���Ȼ��ⷢ���ӳɷ�Ӧ | D�� | ��Ȳ���Ȼ��ⷢ���ӳɷ�Ӧ |
| A�� | ֻ�н���Ԫ�غͷǽ���Ԫ�ػ���ʱ�����γ����Ӽ� | |
| B�� | ���ʷ����о����ڻ�ѧ�� | |
| C�� | �������Ӽ�ͨ�������������γɵĻ�ѧ���������Ӽ� | |
| D�� | ���й��ۼ��Ļ����ﲻһ���ǹ��ۻ����� |