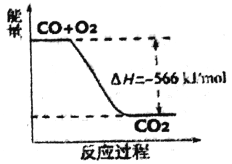
题目内容
【题目】氮的固定对人类的生存发展具有重要意义,科学家一直致力于“人工固氮”的新方法研究。
(1)豆科植物的根瘤菌含有一种固氮酶,能在常温下将空气中的氮气转化为自身生长所需的含氮化合物,下列说法错误的是____(填标号)。
a.固氮酶是一种蛋白质
b.固氮酶能降低固氮反应发生所需的能量
c.固氮酶能使固氮反应的平衡正向移动
d.固氮酶能加快固氮反应的速率
(2)合成氨是目前最重要的固氮方法。下图为合成氨反应N2(g)+3H2(g) ![]() 2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线。
2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线。
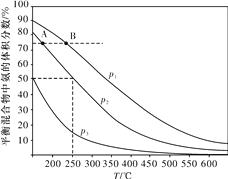
①A、B两平衡状态相比较,前者较大的是____(填标号)。
a.平衡常数
b.平衡混合物的平均摩尔质量
c.氢气的转化率
d.从反应开始至达到平衡状态所需要的时间
②图中p1、p2、p3由大到小的顺序为____。
③在250 ℃、p2下,H2的转化率为____%(结果保留小数点后一位)。
(3)据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和一种单质。已知:
①H2(g)+![]() O2(g)===H2O(l) ΔH1=-285.6 kJ/mol
O2(g)===H2O(l) ΔH1=-285.6 kJ/mol
②N2(g)+3H2(g) ![]() 2NH3(g) ΔH2=-92.2 kJ/mol
2NH3(g) ΔH2=-92.2 kJ/mol
写出此条件下氮气和水反应的热化学方程式:___。
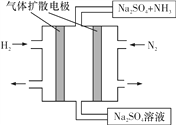
(4)下图为一种常温常压下水溶液中电化学合成氨的实验装置示意图。请据此写出其正极反应的电极反应式:__。
【答案】 c ad p1>p2>p3 66.7 2N2(g)+6H2O(l)===4NH3(g)+3O2(g) ΔH=+1529.2kJ/mol_ N2+6e-+6H2O=2NH3+6OH-(或N2+6e-+6H+=2NH3)
【解析】(1)a.酶都属于蛋白质,所以固氮酶是一种蛋白质,故a正确;b.固氮酶起到了催化剂的作用,所以固氮酶能降低固氮反应发生所需的能量,使反应在常温下就可以进行,故b正确;c.催化剂只能改变反应速率,不能影响化学平衡,所以固氮酶不能使固氮反应的平衡正向移动,故c错误;d.催化剂能够加快反应速率,所以固氮酶能加快固氮反应的速率,故d正确;故答案为:c;
(2)①a.平衡常数只受温度影响,根据图像可知,A点的温度小于B,合成氨的反应为放热反应,温度升高,平衡向着逆向移动,平衡常数减小,所以A的平衡常数大于B,故A正确;b.A、B都处于平衡状态时,氨气的体积分数相等,则氮气和氢气的体积分数也相等,则混合气体的平均摩尔质量:A=B,故B错误;c.氢气的转化率:由于A、B达到平衡状态时各组分的含量完全相同,所以氢气的转化率:A=B,故c错误;d.B的压强、温度都大于A,则B的反应速率大于A,所以B优先达到平衡状态,即从反应开始至达平衡状态所需要的时间:A>B,故d正确;故答案为:ad;
②相同温度下,压强增大,平衡正向移动,氨气的体积分数增大,氨气的体积分数关系为:p1>p2>p3,则压强大小为:p1>p2>p3,故答案为:p1>p2>p3,
③在250℃、1.0×104kPa下,初始时氮气、氢气的体积比为1:3,氨气的体积分数为50%,设氮气的转化率为x,则
N2(g)+3H2(g)2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
所以![]() =50%,解得x=
=50%,解得x=![]() ,则氢气的转化率为:
,则氢气的转化率为: ![]() ×100%≈66.7%,故答案为:66.7;
×100%≈66.7%,故答案为:66.7;
(3)①H2(g)+ ![]() O2(g)═H2O(1)△Hl═-285.6kJ/mol②N2(g)+3H2(g)═2NH3(g)△H2═-92.2kJ/mol,
O2(g)═H2O(1)△Hl═-285.6kJ/mol②N2(g)+3H2(g)═2NH3(g)△H2═-92.2kJ/mol,
氮气与水反应的化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),
根据盖斯定律,②×2-①×6可得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=2△H2-6△Hl═+1529.2kJ/mol,故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1529.2kJ/mol;
(4)根据图示可知,正极上氮气得到电子发生还原反应生成氨气,电极反应式为:N2+6e-+6H2O=2NH3+6OH-,故答案为:N2+6e-+6H2O=2NH3+6OH-。