��Ŀ����
����Ŀ����.����4FeS2+11O2�T2Fe2O3+8SO2���Իش��йص����⣺
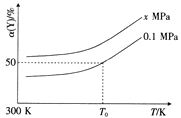
��1����ѡ����Щ����Ũ�ȵı仯����ʾ�÷�Ӧ������____________��
��2��Ϊ���������SO2�����ʣ����Բ�ȡ�Ĵ�ʩ��______________��
A������FeS2���� B������O2��Ũ�� C�������¶� D����Сѹǿ
����ij���淴Ӧ��ij���Ϊ5L���ܱ������н��У��ڴ�0��3���Ӹ����ʵ����ı仯�����ͼ��ʾ��A��B��C��Ϊ���壩
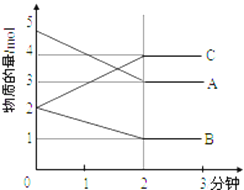
��3���÷�Ӧ�Ļ�ѧ����ʽΪ_________________��
��4����һ���¶��£����������ܱ������У�������Ӧ�ﵽƽ��ı�־��_______________
A���������������ֲ���
B��A��B��C��Ũ�ȶ����
C��A��B��C��Ũ�Ȳ��ٷ����仯
D��A��B��C�ķ�����֮��Ϊ2��1��2
E������Ӧ���淴Ӧ����ֹͣ
F�������������ܶȲ��ٷ����仯��
���𰸡� O2��SO2 B C 2A+B2C C
�����������������������1��FeS2��Fe2O3Ϊ���壬����������ʾ��Ӧ���ʣ�O2 ��SO2Ϊ���壬����O2 ��SO2Ũ�ȵı仯����ʾ�÷�Ӧ�����ʡ�
��2��A��FeS2Ϊ���壬����FeS2��������Ӱ�컯ѧ��Ӧ���ʣ�����B������O2��Ũ�ȣ���Ӧ��Ũ�ȱ��Ӧ���ʼӿ죬��ȷ��C�������¶ȣ���ѧ��Ӧ���ʼӿ죬��ȷ��D����Сѹǿ����Ӧ���ʼ�С������
������3������ͼ���֪A��B���ʵ������٣�Ϊ��Ӧ�C���ʵ�������Ϊ�����2����ʱ�ﵽƽ�⣬�÷�ӦΪ���淴Ӧ��0��2����A��B��C���ʵ����ñ����ֱ�Ϊ2mol��1mol��2mol�����Ը÷�Ӧ�Ļ�ѧ����ʽΪ��2A(g) + B(g)![]() 2C(g)��
2C(g)��
��4��A�����������غ㣬���۷�Ӧ�Ƿ�ƽ�⣬�������������ֲ��䣬�����������������ֲ��䲻���жϷ�Ӧ�ﵽƽ�⣬����B��A��B��C��Ũ���Ƿ�����뷴Ӧ�Ƿ�ƽ���أ�����C��A��B��C��Ũ�Ȳ��ٷ����仯��˵������Ӧ���ʵ����淴Ӧ���ʣ�˵����Ӧ�ﵽƽ�⣬��ȷ��D��A��B��C�ķ�����֮���뷴Ӧ�Ƿ�ƽ���أ�����E����Ӧƽ��ʱ����Ӧ���ʵ����淴Ӧ���ʣ�����0������F�����������غ㶨�ɣ������������䣬����������̶��������Ƿ�ƽ�⣬�ܶȱ��ֲ��䣬���������������ܶȲ��ٷ����仯�������жϷ�Ӧ�ﵽƽ�⣬����

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�