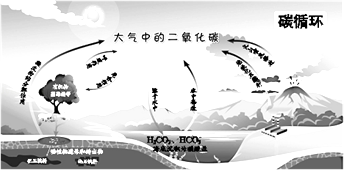
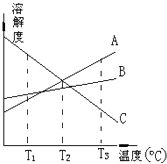
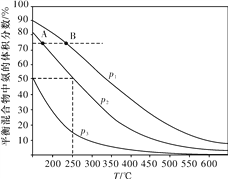
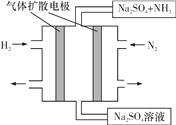
题目内容
【题目】利用下列实验装置进行的相应实验,不能达到实验目的是( ) 
A.图1装置可制取氨气
B.图2装置可分离CH3COONa和CH3COOC2H5混合液
C.图3所示装置可制取乙烯并验证其易被氧化
D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
【答案】B
【解析】解:A.浓氨水与碱石灰制取氨气,选固体与液体反应不需要加热装置,则图中装置能实现氨气的制取,故A正确; B.CH3CH2OH和CH3COOC2H5不分层,则不能利用图中分液装置操作,故B错误;
C.乙醇挥发后溶解在KOH溶液中,排除对乙烯检验的干扰,则图中装置能制取乙烯并验证其易被氧化,故C正确;
D.浓硫酸使蔗糖变黑,体现脱水性,与C反应生成二氧化硫,体现其强氧化性,图中品红褪色,说明二氧化硫具有漂白性,高锰酸钾溶液褪色,发生氧化还原反应,说明二氧化硫具有还原性,所以图中装置能说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性,故D正确;
故选B.

【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. ①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式: . 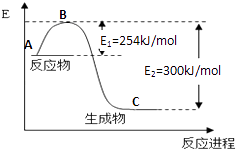
②已知:
化学键 | H﹣H | N≡N |
键能(kJ/mol) | 435 | 943 |
试根据上表及图1中的数据计算N﹣H键的键能为kJ/mol.
③若起始时向容器内放入1mol N2和3mol H2 , 10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知: CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=﹣53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)CH3OCH3 (g)+3H2O(g)△H3=kJ/mol.