题目内容
16.为检验溶液中是否含有Cl-,某同学采用向溶液中先加HNO3,再加AgNO3,溶液的实验方案,若有白色沉淀生成,则证明有Cl-.对此结论,有人提出了质疑,设计了如下探究性实验.实验一:向Na2SO4溶液中滴加AgNO3溶液
| 编号 | Na2S04溶液 | AgN03溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积/滴 | 浓度/(mol•L-1) | ||
| ① | 1 | l | 3 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3 | 0.0l | 无明显变化 |
(2)学生设计了如下表格,对实验一内容进行理论计算,请帮他完成表格.(表中不要留空格).
[25℃时Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10]
| 编号 | AgNO3浓度/(mol•L-1) | 稀释后Ag+浓度/(mol•L-1) | 混合液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.0l | 0.12 |
| ④ | 0.001 |
A.混合液中c(SO42-)=0.1mol/L时不会产生Ag2SO4沉淀
B.混合液中c(SO42-)=1mol/L时不会产生Ag2SO4沉淀
c.无论SO42-浓度大小都会产生Ag2SO4沉淀
D.若使用0.01mol/L AgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰
(3)将实验一中编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾.为探究真相,在实验一的基础上继续设计了以下实验.
实验二:
| 编号 | AgNO3溶液 浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
假设一:H+对Ag2SO4溶解起作用.
假设二:NO3-对Ag2SO4溶解起作用.
(4)从下列限选试剂中选择适当试剂并设计实验方案,分别验证假设一和假设二是否成立.请 写出实验步骤和结论.(限选试剂:Ag2SO4固体、浓HNO3、NaNO3饱和溶液、CaSO4固体)①取少量CaSO4固体于试管中,加入一定量浓HNO3,充分振荡.若沉淀溶解,说明假设一成立.
②取少量Ag2SO4固体于试管中,加入一定量NaNO3饱和溶液,充分振荡.若沉淀溶解,说明假设二成立
(5)通过(4)的实验,若证实假设一成立,请用平衡理论解释Ag2SO4溶解的原因Ag2SO4固体在水中存在平衡:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),H+与SO42-结合生成HSO4-,SO42-浓度降低,平衡正向移动,Ag2SO4不断溶解.
分析 (1)向Na2SO4溶液中滴加AgNO3溶液,出现白色沉淀,说明生成硫酸银,据此书写离子反应方程式;
(2)依据表格得知四次实验中AgNO3浓度/(mol•L-1)依次减小,对比稀释后Ag+浓度/(mol•L-1),应为稀释10倍,依据Ksp(Ag2SO4)=1.2×10-5,填写实验④中混合液中SO42-的最小理论检出浓度/(mol•L-1);依据溶度积常数判断是否产生沉淀;
(3)硝酸中存在氢离子和硝酸根,从这两种离子对银离子的影响假设即可;
(4)若稀硝酸能溶解硫酸该固体,则说明假设一成立;若硝酸钠能使硫酸银溶解,说明假设二成立,据此解答即可;
(5)Ag2SO4固体在水中存在平衡:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),加入氢离子,氢离子与硫酸根结合,据此判断即可.
解答 解:(1)硫酸银为微溶于水的白色沉淀,故硫酸钠中滴入硝酸银生成白色沉淀的离子反应方程式为:2Ag++SO42-═Ag2SO4↓,故答案为:2Ag++SO42-═Ag2SO4↓;(2)对比实验①③得知,应为稀释10倍,故②中银离子浓度为:0.5÷10=0.05mol/L; ④中硝酸银浓度为:0.001×10=0.01mol/L;由于25℃时Ksp(Ag2SO4)=1.2×10-5,故混合液中SO42-的最小理论检出浓度/(mol•L-1)=$\frac{Ksp(A{g}_{2}S{O}_{4})}{{c}^{2}(A{g}^{+})}=\frac{1.2×1{0}^{-5}}{(0.001)^{2}}$=12;向l mL某溶液中加入3滴0.1mol/L AgNO3溶液;
A、依据实验③得出此种银离子浓度下,当c(SO42-)>0.12mol/L时才产生Ag2SO4沉淀,故A正确,
B、混合液中c(SO42-)=1mol/L时会产生Ag2SO4沉淀,故B正确;
C、依据AB可知,硫酸根离子达到一定程度,会产生硫酸银沉淀,故C错误;
D、由此实验得出若使用0.01mol/L AgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰,故D正确,故选AD,
故答案为:0.05;0.01;12;AD;
(3)硝酸只能电离出氢离子和硝酸根,结合题意假设二为:NO3-对Ag2SO4溶解起作用,据此得出:假设一:H+对Ag2SO4溶解起作用,故答案为:H+对Ag2SO4溶解起作用;
(4)结合所给的试剂,①若稀硝酸能溶解硫酸该固体,则说明假设一成立,设计实验为:取少量CaSO4固体于试管中,加入一定量浓HNO3,充分振荡.若沉淀溶解,说明假设一成立,故答案为:取少量CaSO4固体于试管中,加入一定量浓HNO3,充分振荡.若沉淀溶解,说明假设一成立;
②若硝酸钠能使硫酸银溶解,说明假设二成立,设计实验为:取少量Ag2SO4固体于试管中,加入一定量NaNO3饱和溶液,充分振荡.若沉淀溶解,说明假设二成立,
故答案为:取少量Ag2SO4固体于试管中,加入一定量NaNO3饱和溶液,充分振荡.若沉淀溶解,说明假设二成立;
(5)Ag2SO4固体在水中存在平衡:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),H+与SO42-结合生成HSO4-,SO42-浓度降低,平衡正向移动,Ag2SO4不断溶解,
故答案为:Ag2SO4固体在水中存在平衡:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),H+与SO42-结合生成HSO4-,SO42-浓度降低,平衡正向移动,Ag2SO4不断溶解.
点评 本题主要考查的是沉淀溶度积常数的应用,涉及离子反应方程式的书写、实验方案的设计与评价等,综合性较强,难度较大.

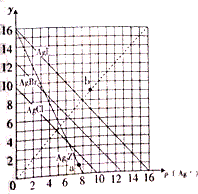 卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )| A. | 该温度下Ag2Z的Ksp约为1×10-8 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点可表示AgI的过饱和溶液,且c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr形成的混合溶液的饱和溶液中:c(Cl-)<c(Br-) |
| A. | 质量数是60 | B. | 质子数是 27 | C. | 中子数是33 | D. | 电子数是33 |
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
| A. |
| B. |
| C. |
| D. |
|
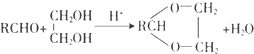
 .
.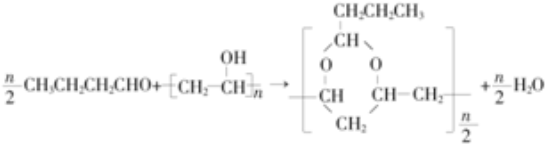 .
.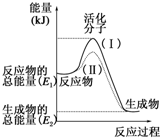 请认真观察如图,然后回答问题.
请认真观察如图,然后回答问题.