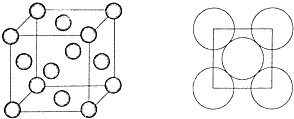
题目内容
20.TiCl4是一种重要的化工原料,其工业生产过程如下:2FeTiO3(s)+7Cl2(g)+6C (s)$\stackrel{900℃}{?}$2TiCl4 (g)+2FeCl3(g)+6CO(g)-Q (Q>0)
(1)该反应达到平衡后,若使正反应速率增大可采取的方法有ac.(选填编号)
a.加压 b.加入碳 c.升温 d.及时移走CO
(2)若上述反应在固定体积的密闭容器中发生,一定能说明反应已达平衡的是bc.(选填编号)
a.反应物不再转化为生成物
b.炉内FeTiO3与TiCl4 的质量比保持不变
c.反应的热效应不再改变
d.单位时间内,n(FeTiO3)消耗:n(FeCl3)生成=1:1
(3)上述反应中所有非金属元素原子的半径从大到小的顺序为Cl>C>O;其中不属于同周期又不属于相邻族的两元素形成非极性分子(填“极性”或“非极性”),通过比较最高价氧化物对应水化物的酸性可以判断这两种元素的非金属性.
(4)上述反应中,非金属性最弱的元素原子的电子共占据4个原子轨道,最外层电子排布式为2s22p2.它形成的固态单质中只含一种强烈的相互作用力,则该单质属于原子晶体.
(5)为方便获得氯气,工业制TiCl4厂可以和氯碱厂进行联合生产.CO可合成甲醇,若不考虑损失,上述联合生产在充分利用各种副产品的前提下,合成192kg甲醇,至少需补充H25000mol.
分析 (1)增加对于有气体参加的反应增大压强可以加快化学反应速率,升高温度可以加快化学反应速率,而固体量的改变不改变反应速率,及时移走CO生成物的浓度减小,反应速率减慢;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)上述反应中所有非金属元素有Cl、C、O,电子层数越多半径越大,电子层数相同时,核电荷数越多半径越大;
(4)上述反应中,非金属性最弱的元素原子是碳,电子共占据1s、2s、2px、2py四个轨道,固态单质金刚石中只含一种强烈的相互作用力,是共价键,是原子晶体;
(5)根据甲醇的物质的量计算需要CO、H2的物质的量,根据n(CO)计算电解中生成的n(Cl2),进而计算电解生成n(H2),据此计算解答.
解答 解:(1)a.加压,正逆反应速率都加快,故正确;
b.加入碳,固体量的改变不改变反应速率,故错误;
c.升温,正逆反应速率都加快,故正确;
d.及时移走CO,生成物的浓度减小,正逆反应速率都减慢,故错误;故选:ac;
(2)a.反应物不再转化为生成物,化学平衡是动态平衡,故错误;
b.炉内FeTiO3与TiCl4 的质量比保持不变,说明正逆反应速率相等,达平衡状态,故正确;
c.反应的热效应不再改变,说明正逆反应速率相等,达平衡状态,故正确;
d.单位时间内,n(FeTiO3)消耗:n(FeCl3)生成=1:1,未体现正与逆的关系,故错误;故选:bc;
(3)上述反应中所有非金属元素有Cl、C、O,电子层数越多半径越大,电子层数相同时,核电荷数越多半径越大,所以原子半径的大小为:Cl>C>O;其中不属于同周期又不属于相邻族的两元素形成四氯化碳是非极性分子,可以通最高价氧化物对应的水化物的酸性强弱,来判断元素的非金属性强弱,故答案为:Cl>C>O;非极性; 最高价氧化物对应水化物的酸性;
(4)上述反应中,非金属性最弱的元素原子是碳,电子共占据1s、2s、2px、2py四个轨道,最外层电子排布式为 2s22p2,固态单质金刚石中只含一种强烈的相互作用力,是共价键,是原子晶体,故答案为:4; 2s22p2;原子;
(5)由CO(g)+2H2(g)?CH3OH(g)可知,合成6000mol甲醇需要n(CO)=6000mol、n(H2)=12000mol.根据2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO可知,电解中生成的n(Cl2)=$\frac{7}{6}$n(CO)=7000mol,根据2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑可知,电解生成n(H2)=n(Cl2)=7000mol,故需额外补充H2 为12000mol-7000mol=5000mol,
故答案为:5000.
点评 本题的综合性很强,侧重分析能力及计算能力的考查,涉及化学反应方程式的书写,化学平衡、电解等多方面内容,注意知识的迁移应用,对学生能力要求较高,题目难度较大.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
| A. | 化学反应的实质是旧键的断裂和新化学键生成 | |
| B. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| C. | 在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是吸热反应 | |
| D. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 |
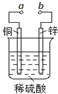
| A. | 当a和b用导线连接时,溶液中的SO42-向铜片附近移动 | |
| B. | 将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法 | |
| C. | 当a和b用导线连接时,铜片上发生的反应为:2H++2e→H2↑ | |
| D. | a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体 |
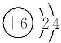 B.
B.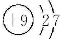 C.
C. D.
D.
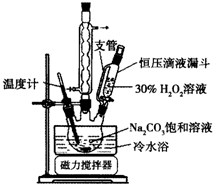 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.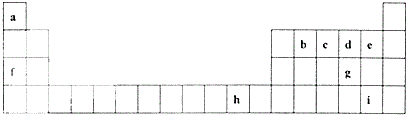 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素. .
.