题目内容
15.如图可设计成多种用途的电化学装置.下列分析正确的是( )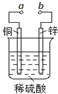
| A. | 当a和b用导线连接时,溶液中的SO42-向铜片附近移动 | |
| B. | 将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法 | |
| C. | 当a和b用导线连接时,铜片上发生的反应为:2H++2e→H2↑ | |
| D. | a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体 |
分析 若a和b用导线连接,该装置是原电池,锌作负极,铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,阳离子移向正极铜,阴离子移向负极锌;若a与电源正极相连,该装置是电解池,则铜为阳极,锌为阴极,可以保护锌被腐蚀,这叫外接电源的阴极保护法,据此分析.
解答 解:A.a和b用导线连接,该装置是原电池,锌作负极,铜作正极,阳离子移向正极铜,阴离子移向负极锌,所以溶液中的SO42-向锌片附近移动,故A错误;
B.a与电源正极相连,该装置是电解池,则铜为阳极,锌为阴极,可以保护锌被腐蚀,这叫外接电源的阴极保护法,故B错误;
C.a和b用导线连接时,该装置是原电池,锌作负极,铜作正极,铜片上发生的反应为:2H++2e→H2↑,故C正确;
D.a和b用导线连接时,该装置是原电池,铜作正极,铜片上发生的反应为:2H++2e→H2↑,所以电路中通过0.02mol电子时,产生0.01mol气体,故D错误.
故选C.
点评 本题考查原电池和电解池原理,根据电极上得失电子及其反应类型来分析解答,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,电解过程的反应原理应用,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 需要加热的化学反应都是吸热反应 | |
| B. | 水力发电是将化学能转化为电能的过程 | |
| C. | 食醋、纯碱、食盐分别属于酸、碱、盐 | |
| D. | 生铁、不锈钢、青铜都属于合金 |
3.亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但在酸性溶液发生分解:5HClO2→4ClO2+H++Cl-+2H2O.
向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为pH相同的稀硫酸,开始时反应缓慢,稍后产生气体速度较快,速度变化的原因是( )
向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为pH相同的稀硫酸,开始时反应缓慢,稍后产生气体速度较快,速度变化的原因是( )
| A. | 逸出ClO2使生成物浓度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |
16.用10mL 0.1mol/L BaCl2溶液恰好可分别使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的SO42-完全转化为硫酸钡沉淀,则这三种硫酸盐的物质的量浓度之比为( )
| A. | 1:1:3 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:2 |
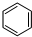 (g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$
(g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$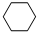 (g)
(g) 
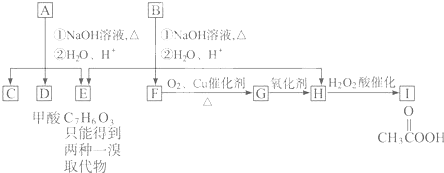
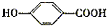
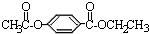 A经①②两步反应得C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
A经①②两步反应得C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如下图所示.
 .
. 或
或 .
.