题目内容
8.在25℃,Na2SO3溶液吸收SO2得到的NaHS03溶液中c(SO32-)>c(H2SO3),据此断NaHS03溶液显酸性.分析 Na2SO3溶液吸收SO2得到的NaHS03溶液中c(SO32-)>c(H2SO3),说明溶液中亚硫酸氢根离子电离程度大于其水解程度,溶液呈酸性;
解答 解:Na2SO3溶液吸收SO2得到的NaHS03溶液中,NaHSO3=Na++HSO3-,HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,溶液中c(SO32-)>c(H2SO3),说明溶液中亚硫酸氢根离子电离程度大于其水解程度,溶液呈酸性;
故答案为:酸.
点评 本题考查了演的水解、弱酸根离子的水解分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
18.已知A、B、C、D、E、F为 元素周期表前四周期原子序数依次增大的六种元素,其中A的一种同位素原子中无中子,B的一种核素在考古时常用来鉴定一些文物的年代,D与E同主族,且E的原子序数是D的2倍,F元素在地壳中的含量位于金属元素的第二位.试回答下列问题:
(1)F元素价层电子排布式为3d64s4.
(2)关于B2A2的下列说法中正确的是②④.
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键形成的非极性分子
③每个B2A2分子中σ键和π键数目比为1:1
④B2A2分子中的A-B键属于s-spσ键
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为N>O>C(用元素符号表示).B、C、D三种元素中与BD2互为等电子体的分子式为N2O.(用元素符号表示)
(4)A2E分子中心原子的杂化类型为sp3.比较A2D与A2E分子的沸点,其中沸点较高的原因为H2O分子之间存在氢键.元素D可形成两种同素异形体,其中在水中溶解度更大的是O3(填分子式).
(5)F单质的晶体在不同温度下有两种堆积方式,信息如下:
则方式Ⅰ与方式Ⅱ中F原子配位数之比为3:2,晶体密度之比为2b3:a3.
(1)F元素价层电子排布式为3d64s4.
(2)关于B2A2的下列说法中正确的是②④.
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键形成的非极性分子
③每个B2A2分子中σ键和π键数目比为1:1
④B2A2分子中的A-B键属于s-spσ键
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为N>O>C(用元素符号表示).B、C、D三种元素中与BD2互为等电子体的分子式为N2O.(用元素符号表示)
(4)A2E分子中心原子的杂化类型为sp3.比较A2D与A2E分子的沸点,其中沸点较高的原因为H2O分子之间存在氢键.元素D可形成两种同素异形体,其中在水中溶解度更大的是O3(填分子式).
(5)F单质的晶体在不同温度下有两种堆积方式,信息如下:
| 序号 | 堆积方式 | 晶胞棱长(cm) |
| Ⅰ | 面心立方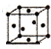 | a |
| Ⅱ | 体心立方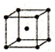 | b |
19.短周期元素R、X、Y、Z原子序数依次增大,其中R的气态氢化物的水溶液呈碱性,X是同周期中原子半径最大的元素,Y的单质是一种常见的半导体材料,Y与Z的原子序数相差3,下列判断正确的是( )
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y>Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | X和Y两者最高价氧化物对应的水化物能相互反应 |
3.亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但在酸性溶液发生分解:5HClO2→4ClO2+H++Cl-+2H2O.
向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为pH相同的稀硫酸,开始时反应缓慢,稍后产生气体速度较快,速度变化的原因是( )
向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为pH相同的稀硫酸,开始时反应缓慢,稍后产生气体速度较快,速度变化的原因是( )
| A. | 逸出ClO2使生成物浓度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |
13.与溴水反应不会产生沉淀的是( )
| A. | 乙烯 | B. | AgNO3溶液 | C. | H2S | D. | 苯酚 |
9.Murad等三位教授最早提出NO分子在人体内独特功能.近年来此领域研究有很大进展,因此这三位教授荣获1998年诺贝尔医学奖及生理学奖.下列关于NO的叙述不正确的是( )
| A. | NO对环境的危害在于破坏臭氧层、形成酸雨等方面 | |
| B. | NO可以是某些高价N物质的还原产物也可以是某些含低价N物质的氧化产物 | |
| C. | 实验室制取的NO可以用用排水法和向上排空气法收集 | |
| D. | 生物体内存在少量NO能提高其生理机能,如扩张血管、促进免疫力 |
10.25℃某气态烃与氧气混合充入密闭容器中,点火爆炸后又恢复到25℃,此时容器内压强为开始时的一半,再经氢氧化钠溶液处理,容器内几乎为真空,该烃的分子式为( )
| A. | C2H4 | B. | C3H6 | C. | C2H6 | D. | C4H8 |
 CO2:
CO2: MgCl2:
MgCl2: Na2O2:
Na2O2: .
.