题目内容
4.(1)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为62g/mol,X的相对原子质量为16(2)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍.则X的相对原子质量为32.
(3)0.05mol 的硫酸钠中含有0.2NA个氧原子;与5.85g NaCl中所含有的Na+数目相同.
(4)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mLA受热完全分解生成15mLO2和10mL F2,则A的化学式为O3F2.
(5)0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为1.5mol/L.
(6)质量分数为98%,密度为1.84g.cm-3的某浓硫酸,溶质的物质的量浓度为18.4mol/L.
(7)a个X原子的总质量为b g,则X的相对原子质量可表示为$\frac{b}{a}{N}_{A}$.
分析 (1)根据M=$\frac{n}{m}$计算Na2X的摩尔质量,钠原子的相对原子质量是23,据此求算X的相对原子质量;
(2)同温同压下,密度之比等于相对分子质量之比,据此计算H2X的相对分子质量,进而计算X的相对原子质量;
(3)结合物质的构成及m=nM计算,1mol的硫酸钠中含有4mol氧原子,1molNaCl中所含有的Na+数为1mol;
(4)同温同压下,体积之比等于物质的量之比,再根据原子守恒确定A的化学式;
(5)根据溶液的浓度和化合物的构成计算溶质离子浓度;
(6)物质的量浓度与溶质的质量分数的转化关系为:c=$\frac{1000ρω}{M}$,将题中数据带入计算出该溶液的物质的量浓度即可;
(7)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算,摩尔质量在数值上等于其相对原子质量.
解答 解:(1)12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=$\frac{1}{2}$n(Na+)=0.4mol×$\frac{1}{2}$=0.2mol,Na2X的摩尔质量为:M(Na2X)=$\frac{12.4g}{0.2mol}$=62g/mol;钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16;X为氧原子,该物质的化学式为Na2O,
故答案为:62g/mol;16;
(2)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍,则二者密度之比为2:1,同温同压下,密度之比等于相对分子质量之比,H2X的相对分子质量为17×2=34,则X的相对原子质量为34-2=32,
故答案为:32;
(3)0.05mol 的硫酸钠中含有0.05mol×4=0.2molO,个数为0.2NA=1.204×1023(0.2NA),含钠离子为0.05mol×2=0.1mol,与0.1mol×59.5g/mol=5.85gNaCl含相同的钠离子数,
故答案为:1.204×1023(0.2NA);5.85;
(4)同温同压下,体积之比等于物质的量之比,故A、O2和F2的物质的量之比=10:15:10=2:3:2,则该反应方程式为:2A$\frac{\underline{\;\;△\;\;}}{\;}$3O2+2F2,根据原子守恒可知A的化学式为:O3F2,
故答案为:O3F2;
(5)FeCl3在溶液中完全电离,由FeCl3可知,氯离子浓度是FeCl3浓度3倍,所以0.5L 0.5mol/L FeCl3溶液中c(Cl-)=3c(FeCl3)=3×0.5mol/L=1.5mol/L,
故答案为:1.5mol/L;
(6)该硫酸溶液的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故答案为:18.4mol/L;
(7)a个X原子的总质量为b g,则NA个原子的质量为$\frac{b}{a}{N}_{A}$g,即:1molX原子的总质量为$\frac{b}{a}{N}_{A}$g,摩尔质量在数值上等于其相对原子质量,所以X原子相对原子质量为:$\frac{b}{a}{N}_{A}$,
故答案为:$\frac{b}{a}{N}_{A}$.
点评 本题主要考查物质的量的计算,题目难度中等,注意质量守恒定律、摩尔质量在数值上等于其相对分子质量等概念的运用,注意物质的量浓度与溶质质量分数的转化关系,试题侧重对学生能力的培养和解题方法的指导和训练.

 计算高手系列答案
计算高手系列答案| A. | 取浸取液少许,滴入AgNO3溶液有白色沉淀产生,则可能含有Cl- | |
| B. | 取浸取液少许,加入Cu和浓H2SO4,试管口有红棕色气体产生,则可能含有NO3- | |
| C. | 取浸取液少许,滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,则一定含SO42- | |
| D. | 用洁净的铂丝棒蘸取浸取液,在酒精灯外焰上灼烧,焰色呈黄色,则一定含有Na+ |
向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为pH相同的稀硫酸,开始时反应缓慢,稍后产生气体速度较快,速度变化的原因是( )
| A. | 逸出ClO2使生成物浓度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |
| A. | NO对环境的危害在于破坏臭氧层、形成酸雨等方面 | |
| B. | NO可以是某些高价N物质的还原产物也可以是某些含低价N物质的氧化产物 | |
| C. | 实验室制取的NO可以用用排水法和向上排空气法收集 | |
| D. | 生物体内存在少量NO能提高其生理机能,如扩张血管、促进免疫力 |
| A. | 1:1:3 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:2:2 |
(1)煤的气化:用化学方程式表示出煤的气化的主要反应C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2:
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |
②K3=2.5,若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”、“<”、“=”) CH3OH的消耗速率.
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯).

①为尽可能多地获得乙烯,控制的生产条件为530℃、0.1Mpa.
②一定温度下某密闭容器中存在反应,2CH3OH(g)?CH2=CH2(g)+2H2O(g)在压强为P1 时,产物水的物质的量与时间的关系如图2所示,若t0 时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字),若在t1 时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时问的关系图.
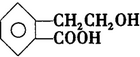 ,它可通过不同化学反应分别制得B、C、D 和E四种物质.
,它可通过不同化学反应分别制得B、C、D 和E四种物质.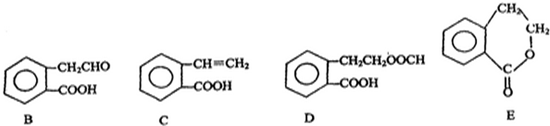
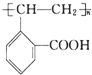 .
. +H2O.
+H2O.