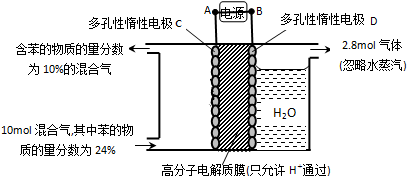
题目内容
10.分子式为C4H8O2,且含有-COO-结构的同分异构体有几种( )| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 根据官能团异构和位置异构和碳链异构来综合分析同分异构体的种数,对于羧酸而言,根据羧基位置异构可以得到两种丁酸;根据酯基位置异构和碳链异构可得:甲酸丙酯2种(丙基2种异构)、乙酸乙酯1种、丙酸甲酯1种.
解答 解:对于羧酸而言,根据羧基位置异构可以得到两种丁酸;根据酯基位置异构和碳链异构可得:甲酸丙酯2种(丙基2种异构)、乙酸乙酯1种、丙酸甲酯1种,共4种,
故选:B.
点评 本题考查同分异构体的种类,根据官能团异构和位置异构和碳链异构来综合分析同分异构体的种数,难度不大,但要注意按照一定的顺序书写同分异构体.

练习册系列答案
相关题目
16.化学与生活、社会密切相关,下列有关说法中正确的是( )
| A. | “低碳生活”是指生活中尽量使用含碳量较低的物质 | |
| B. | 燃煤中加入CaO后可减少酸雨的发生及温室气体的排放 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 |
1.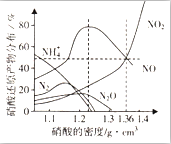 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )| A. | 稀硝酸与铁反应,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+ | |
| C. | 某硝酸试剂瓶的标签注明:密度为1.26g•cm-3,质量分数50.0%;若取该试剂10ml配成100ml溶液,所得溶液pH=1 | |
| D. | 当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,消耗的铁与被还原的硝酸物质的量之比为1:1 |
18.已知A、B、C、D、E、F为 元素周期表前四周期原子序数依次增大的六种元素,其中A的一种同位素原子中无中子,B的一种核素在考古时常用来鉴定一些文物的年代,D与E同主族,且E的原子序数是D的2倍,F元素在地壳中的含量位于金属元素的第二位.试回答下列问题:
(1)F元素价层电子排布式为3d64s4.
(2)关于B2A2的下列说法中正确的是②④.
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键形成的非极性分子
③每个B2A2分子中σ键和π键数目比为1:1
④B2A2分子中的A-B键属于s-spσ键
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为N>O>C(用元素符号表示).B、C、D三种元素中与BD2互为等电子体的分子式为N2O.(用元素符号表示)
(4)A2E分子中心原子的杂化类型为sp3.比较A2D与A2E分子的沸点,其中沸点较高的原因为H2O分子之间存在氢键.元素D可形成两种同素异形体,其中在水中溶解度更大的是O3(填分子式).
(5)F单质的晶体在不同温度下有两种堆积方式,信息如下:
则方式Ⅰ与方式Ⅱ中F原子配位数之比为3:2,晶体密度之比为2b3:a3.
(1)F元素价层电子排布式为3d64s4.
(2)关于B2A2的下列说法中正确的是②④.
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键形成的非极性分子
③每个B2A2分子中σ键和π键数目比为1:1
④B2A2分子中的A-B键属于s-spσ键
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为N>O>C(用元素符号表示).B、C、D三种元素中与BD2互为等电子体的分子式为N2O.(用元素符号表示)
(4)A2E分子中心原子的杂化类型为sp3.比较A2D与A2E分子的沸点,其中沸点较高的原因为H2O分子之间存在氢键.元素D可形成两种同素异形体,其中在水中溶解度更大的是O3(填分子式).
(5)F单质的晶体在不同温度下有两种堆积方式,信息如下:
| 序号 | 堆积方式 | 晶胞棱长(cm) |
| Ⅰ | 面心立方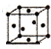 | a |
| Ⅱ | 体心立方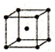 | b |
15.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)→2HCl(g)+Q1
H2(g)+Br2(g)→2HBr(g)+Q2 根据上述反应做出的判断正确的是( )
H2(g)+Cl2(g)→2HCl(g)+Q1
H2(g)+Br2(g)→2HBr(g)+Q2 根据上述反应做出的判断正确的是( )
| A. | Q1>Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1mol HCl(g)放出Q1热量 | |
| D. | 等物质的量时,Br2(g)具有的能量低于Br2(l) |
2.某课外活动小组的同学从采集器中获得雾霾颗粒样品,然后用蒸馏水溶解,得到可溶性成分的浸取液.在探究该浸取液成分的实验中,下列根据实验现象得出的结论错误的是( )
| A. | 取浸取液少许,滴入AgNO3溶液有白色沉淀产生,则可能含有Cl- | |
| B. | 取浸取液少许,加入Cu和浓H2SO4,试管口有红棕色气体产生,则可能含有NO3- | |
| C. | 取浸取液少许,滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,则一定含SO42- | |
| D. | 用洁净的铂丝棒蘸取浸取液,在酒精灯外焰上灼烧,焰色呈黄色,则一定含有Na+ |
19.短周期元素R、X、Y、Z原子序数依次增大,其中R的气态氢化物的水溶液呈碱性,X是同周期中原子半径最大的元素,Y的单质是一种常见的半导体材料,Y与Z的原子序数相差3,下列判断正确的是( )
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y>Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | X和Y两者最高价氧化物对应的水化物能相互反应 |
 (g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$
(g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$ (g)
(g)