题目内容
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.(1)太阳能热水器中常使用一种以镍或镍合金(含铁)空心球为吸收剂的太阳能吸热涂层,回答铁镍基态原子未成对电子数各为
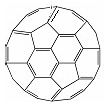
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途.富勒烯(C60)的结构如图,分子中碳原子轨道的杂化类型为
(3)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
a.水的沸点比甲醛高得多,是因为水分子间能形成氢键
b.甲醛、苯和二氧化碳中碳原子均采用sp2杂化
c.苯、二氧化碳是非极性分子,水和甲醛是极性分子
(4)根据价层互诉理论,ClO4-空间构形为
(5)C、N、O电负性由大到小的顺序为
考点:原子核外电子排布,元素电离能、电负性的含义及应用,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)基态Fe原子核外电子排布式为1S22S22P63S23P63d64s2,基态Ni原子核外电子排布式为1S22S22P63S23P63d84s2,据此判断;
(2)每个C原子成3个σ键、没有孤电子对,杂化轨道数目为3,据此确定杂化方式;
利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中σ键的数目;
(3)a.水分子之间存在氢键,而甲醛中H原子不与O原子连接,甲醛分子之间没有氢键;
b.二氧化碳中碳原子含有2个δ键,没有孤对电子,采用sp杂化;
c.结构对称,正负电荷的中心重合,则为非极性分子;正负电荷的中心不重合,则为极性分子;
(4)计算ClO4-中Cl原子价层电子对数、孤对电子对数,确定空间结构;
(5)同周期随原子序数增大元素的电负性增大.
(2)每个C原子成3个σ键、没有孤电子对,杂化轨道数目为3,据此确定杂化方式;
利用均摊法计算每个碳原子含有几个σ键,从而计算1mol C60分子中σ键的数目;
(3)a.水分子之间存在氢键,而甲醛中H原子不与O原子连接,甲醛分子之间没有氢键;
b.二氧化碳中碳原子含有2个δ键,没有孤对电子,采用sp杂化;
c.结构对称,正负电荷的中心重合,则为非极性分子;正负电荷的中心不重合,则为极性分子;
(4)计算ClO4-中Cl原子价层电子对数、孤对电子对数,确定空间结构;
(5)同周期随原子序数增大元素的电负性增大.
解答:
解:(1)基态Fe原子核外电子排布式为1S22S22P63S23P63d64s2,3d轨道有4个单电子;基态Ni原子核外电子排布式为1S22S22P63S23P63d84s2,3d轨道有2个单电子,
故答案为:4;2;
(2)每个C原子成3个σ键、没有孤电子对,杂化轨道数目为3,所以C原子采用sp2 杂化;
每个碳原子含有的σ键个数为
,所以1mol C60分子中σ键的数目=1mol×60×
×NAmol-1=90NA,
故答案为:sp2;90NA;
(3)a.甲醛中H原子不与O原子连接,甲醛分子之间没有氢键,水分子之间存在氢键,沸点比甲醛高,故a正确;
b.甲醛、苯分子中碳原子均含有3个δ键,没有孤对电子,采用sp2杂化,二氧化碳中碳原子含有2个δ键,没有孤对电子,采用sp杂化,故b错误;
c.苯、CO2结构对称,正负电荷的中心重合,为非极性分子;水和甲醛的正负电荷的中心不重合,为极性分子,故c正确,
故答案为:ac;
(4)ClO4-中Cl原子孤电子对数=
=0、价层电子对数=4+0=4,故ClO4-为正四面体结构,
故答案为:正四面体;
(5)C、N、O同周期,随原子序数增大元素的电负性增大,故电负性:O>N>C,
故答案为:O>N>C.
故答案为:4;2;
(2)每个C原子成3个σ键、没有孤电子对,杂化轨道数目为3,所以C原子采用sp2 杂化;
每个碳原子含有的σ键个数为
| 3 |
| 2 |
| 3 |
| 2 |
故答案为:sp2;90NA;
(3)a.甲醛中H原子不与O原子连接,甲醛分子之间没有氢键,水分子之间存在氢键,沸点比甲醛高,故a正确;
b.甲醛、苯分子中碳原子均含有3个δ键,没有孤对电子,采用sp2杂化,二氧化碳中碳原子含有2个δ键,没有孤对电子,采用sp杂化,故b错误;
c.苯、CO2结构对称,正负电荷的中心重合,为非极性分子;水和甲醛的正负电荷的中心不重合,为极性分子,故c正确,
故答案为:ac;
(4)ClO4-中Cl原子孤电子对数=
| 7+1-4 |
| 2 |
故答案为:正四面体;
(5)C、N、O同周期,随原子序数增大元素的电负性增大,故电负性:O>N>C,
故答案为:O>N>C.
点评:本题是对物质结构的考查,涉及核外电子排布、杂化轨道、分子结构与性质、元素周期律、化学键等,难度中等,注意对基础知识的理解掌握.

练习册系列答案
相关题目
下列物质的说法正确的是( )
| A、芳香烃可以来自于煤干馏产品中的煤焦油 |
| B、聚氯乙烯可用于制作食品包装袋 |
| C、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 |
| D、在铁的吸氧腐蚀中,负极是炭,电极反应为2H2O+O2+4e-=4OH- |
已知H2(g)+Br2(g)→2HBr(g)+72kJ.1mol Br2(g)液化放出的能量为30kJ,其它相关数据如下表:
则上述表格中的a值为( )
| H2(g) | Br2(l) | HBr(g) | |
| 1mol 分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
| A、404 | B、344 |
| C、260 | D、200 |
下列各组比较不正确的是( )
| A、锂与水反应不如钠与水反应剧烈 |
| B、还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠 |
| C、熔、沸点:Li>Na>K |
| D、碱性:LiOH<NaOH<KOH |