题目内容
1986年,化学家Karl Christe首次用化学方法制得了F2,他提出的三步反应原理如下:
①KMnO4+H2O2+KF+HF→K2MnF6+O2↑+H2O
②SbCl5+HF→SbF5+HCl
③2K2MnF6+4SbF5═4KSbF6+2MnF3+F2↑.
(1)配平①并标出电子转移的方向和数目: .
(2)若将反应③的变化改用惰性电极进行电解,则F2应当在 极附近逸出.
①KMnO4+H2O2+KF+HF→K2MnF6+O2↑+H2O
②SbCl5+HF→SbF5+HCl
③2K2MnF6+4SbF5═4KSbF6+2MnF3+F2↑.
(1)配平①并标出电子转移的方向和数目:
(2)若将反应③的变化改用惰性电极进行电解,则F2应当在
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)KMnO4+H2O2+KF+HF→K2MnF6+O2↑+H2O中双氧水中O元素化合价由-1价变为0价、Mn元素化合价由+7价变为+4价,根据转移电子相等配平方程式;
(2)2K2MnF6+4SbF5═4KSbF6+2MnF3+F2↑用惰性电极电解时,F元素化合价由-1价变为0价,应该在阳极上放电.
(2)2K2MnF6+4SbF5═4KSbF6+2MnF3+F2↑用惰性电极电解时,F元素化合价由-1价变为0价,应该在阳极上放电.
解答:
解:(1)KMnO4+H2O2+KF+HF→K2MnF6+O2↑+H2O中双氧水中O元素化合价由-1价变为0价、Mn元素化合价由+7价变为+4价,根据转移电子相等得转移电子数为6,再结合原子守恒配平方程式为:2KMnO4+3H2O2+2KF+10HF=2K2Mn F6+3O2↑+8H2O,其转移电子方向和数目为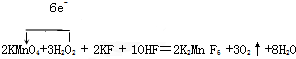 ,故答案为:
,故答案为: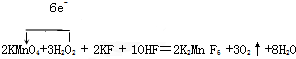 ;
;
(2)2K2MnF6+4SbF5═4KSbF6+2MnF3+F2↑用惰性电极电解时,F元素化合价由-1价变为0价,F元素化合价升高,应该在阳极上放电生成氟气,故答案为:阳.
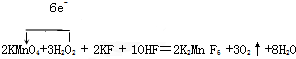 ,故答案为:
,故答案为: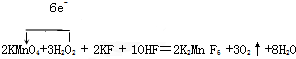 ;
;(2)2K2MnF6+4SbF5═4KSbF6+2MnF3+F2↑用惰性电极电解时,F元素化合价由-1价变为0价,F元素化合价升高,应该在阳极上放电生成氟气,故答案为:阳.
点评:本题考查了氧化还原反应,根据元素化合价变化确定转移电子数,再结合原子守恒、电解原理等知识点分析解答,题目难度不大.

练习册系列答案
相关题目
化学与工农业生产和人类生活密切相关.下列说法中,不正确的是( )
| A、油脂在碱性条件下水解可制得肥皂 |
| B、海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| C、人体中缺碘元素会得贫血病 |
| D、研制推广甲醇燃料汽车,有利于“减排目标”的实现 |
某烷烃的结构简式为: ,下列命名正确的是( )
,下列命名正确的是( )
 ,下列命名正确的是( )
,下列命名正确的是( )| A、2,3-二甲基戊烷 |
| B、2-3-二甲基戊烷 |
| C、2-甲基-3-乙基戊烷 |
| D、2-乙基-3-甲基丁烷 |
 PPA是抗感冒药中禁止添加的物质.已知PPA由四种元素构成,且这四种元素均位于元素周期表的前两周期,其比例模型如图所示.下列有关PPA的说法中正确的是( )
PPA是抗感冒药中禁止添加的物质.已知PPA由四种元素构成,且这四种元素均位于元素周期表的前两周期,其比例模型如图所示.下列有关PPA的说法中正确的是( )| A、PPA的分子式为C9H12NO |
| B、PPA既能与盐酸反应,又能与氢氧化钠溶液反应 |
| C、PPA能发生酯化反应 |
| D、PPA分子中所有碳原子一定在同一平面上 |
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.