题目内容
下列说法正确的是( )
| A、常温下,某溶液中由水电离出的c(H+)=1×10-a mo1?L-1,若a<7时,则该溶液可能为NaHSO4溶液 |
| B、常温下,中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸) |
| C、25℃时,已知Ka (CH3COOH)=1.7×10-5 mo1?L-1、Ka (C6H5OH)=1.0×10-10 mo1?L-1、Ka1(H2CO3)=4.2×10-7 mo1?L-1、Ka2(H2CO3)=5.6×10-11mol?L-1pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:②<③<① |
| D、常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明常温下Ksp(BaSO4)>Ksp(BaCO3) |
考点:弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、某溶液中由水电离出的c(H+)=1×10-a mo1?L-1,若a<7时,说明水的电离受促进;
B、中和同体积、同pH的硫酸、盐酸和醋酸,醋酸中和碱的能力最强;
C、酸越强对应的盐的水解能力越弱,盐溶液的碱性越弱,所以同浓度PH的大小关系为::②>③>①,所以pH相等的三种溶液,c(Na+)大小关系:②<③<①;
D、常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明生成碳酸钡,因为此时的钡离子和碳酸根离子的乘积大于硫酸钡的乘积,所以生成碳酸钡,不能说明常温下Ksp(BaSO4)>Ksp(BaCO3).
B、中和同体积、同pH的硫酸、盐酸和醋酸,醋酸中和碱的能力最强;
C、酸越强对应的盐的水解能力越弱,盐溶液的碱性越弱,所以同浓度PH的大小关系为::②>③>①,所以pH相等的三种溶液,c(Na+)大小关系:②<③<①;
D、常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明生成碳酸钡,因为此时的钡离子和碳酸根离子的乘积大于硫酸钡的乘积,所以生成碳酸钡,不能说明常温下Ksp(BaSO4)>Ksp(BaCO3).
解答:
解:A、某溶液中由水电离出的c(H+)=1×10-a mo1?L-1,若a<7时,说明水的电离受促进,而NaHSO4溶液对水的电离起抑制作用,故A错误;
B、中和同体积、同pH的硫酸、盐酸和醋酸,醋酸中和碱的能力最强,所需相同浓度的NaOH溶液的体积关系:V(硫酸)═V(盐酸)<V(醋酸),故B错误;
C、酸越强对应的盐的水解能力越弱,盐溶液的碱性越弱,所以同浓度PH的大小关系为::②>③>①,所以pH相等的三种溶液,c(Na+)大小关系:②<③<①,故C正确;
D、常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明生成碳酸钡,因为此时的钡离子和碳酸根离子的乘积大于硫酸钡的乘积,所以生成碳酸钡,不能说明常温下Ksp(BaSO4)>Ksp(BaCO3),故D正确;
故选C.
B、中和同体积、同pH的硫酸、盐酸和醋酸,醋酸中和碱的能力最强,所需相同浓度的NaOH溶液的体积关系:V(硫酸)═V(盐酸)<V(醋酸),故B错误;
C、酸越强对应的盐的水解能力越弱,盐溶液的碱性越弱,所以同浓度PH的大小关系为::②>③>①,所以pH相等的三种溶液,c(Na+)大小关系:②<③<①,故C正确;
D、常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明生成碳酸钡,因为此时的钡离子和碳酸根离子的乘积大于硫酸钡的乘积,所以生成碳酸钡,不能说明常温下Ksp(BaSO4)>Ksp(BaCO3),故D正确;
故选C.
点评:本题考查电解质溶液的相关知识,弱电解的电离和盐的水解,题目难度适中.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
下列说法中正确的是( )
| A、所有主族元素的正化合价数,等于它的族序数 |
| B、第ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 |
| C、第ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 |
| D、前三周期元素中共有非金属元素12种 |
NA为阿伏加德罗常数,下列叙述错误的是( )
| A、26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
| B、12g金刚石中含有的共价键键数为4NA |
| C、0.1mol NaHCO3晶体中含0.2NA个离子 |
| D、1mol甲基(-CH3)所含电子数为9NA |
下列离子方程式正确的是( )
| A、Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| B、向小苏打溶液中加入醋酸溶液:HCO3-+H+═CO2↑+H2O |
| C、碳酸钡与硫酸反应:Ba2++SO42-═BaSO4↓ |
| D、向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全NH4++H++SO42-+Ba2++2OH-═NH3?H2O+BaSO4↓+H2O |
已知+4价的S元素具有较强的还原性,某溶液中含有HCO3-、SO32-、CO32-、Cl-等4种阴离子.向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)( )
| A、CO32- |
| B、SO32- |
| C、Cl- |
| D、HCO3- |
下列叙述与对应图式正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 主要化合价 | -2 | +2 | +1 | +5、-3 | +7、-1 | +1 | +5、-3 | +3 |
| A、由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强 |
B、 如图装置中,待镀铁制品应与电源负极相连 |
C、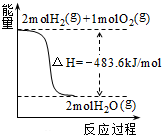 如图表示H2与O2发生反应过程中的能量变化,则H2的燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol |
D、 如图表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 |
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2.则下列说法中正确的是( )
| A、上述过程的氧化剂为H2O2 | ||
B、若上述过程中产生的氧气为1mol,则消耗的H2CrO4为
| ||
| C、上述过程中Cr(OH)3是反应物 | ||
| D、上述过程的氧化产物为H2CrO4 |
在一恒容的密闭容器中,A(g)+B(g)?C(g)的平衡体系中,若增大A的浓度而使平衡向右移动,当达到新的平衡时,则下列说法不正确的是( )
| A、A的平衡浓度一定比原来平衡时大 |
| B、B的平衡浓度一定比原来平衡时小 |
| C、C的百分含量可能比原来平衡时大 |
| D、A的转化率一定比原来平衡时大 |