题目内容
1.研究小组欲进行从海水中获取淡水、食盐并提取镁和溴等物质的实验探究.(1)无需经过化学变化就能从海水中获得的一组物质是④(填序号).
①Cl2、Br2、I2 ②Na、Mg、Al ③烧碱、氢气 ④食盐、淡水
(2)在生产过程中,从海水中提取镁的流程如图所示:
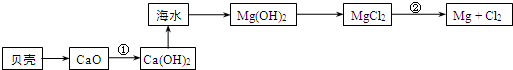
贝壳中的主要成分是:CaCO3(填化学式);反应①属于放热反应(填“吸热”或“放热”).
反应②的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Cl2↑+Mg.
(3)实验室从海水样品中提取溴的主要步骤是:向海水样品中通入适量氯气将溴离子氧化,该反应的离子方程式为Cl2+2Br-=Br2+2Cl-;从反应后的溶液中提取溴单质的实验操作是萃取(填实验操作名称).
分析 (1)从海水制备物质的原理可知,金属单质与非金属单质需要利用化学反应来制取,而食盐可利用蒸发原理,淡水利用蒸馏原理来得到;
(2)贝壳通过反应生成CaO,碳酸钙在高温下分解生成CaO,所以贝壳的主要成分是CaCO3;反应①为CaO和水反应生成Ca(OH)2,该反应为放热反应;Ca(OH)2和镁离子反应生成Mg(OH)2,Mg(OH)2和HCl反应生成MgCl2,采用电解熔融氯化镁的方法制取Mg和氯气;
(3)氯气具有强氧化性,能和溴离子发生置换反应生成溴,溴在有机溶剂中的溶解度大于在水中的溶解度,所以可以采用萃取的方法提取溴.
解答 解:(1)①通过氯气将溴离子和碘离子氧化为溴单质和碘单质,有新物质生成属于化学变化,故①错误;
②从海水中获得氯化钠、氯化镁,电解熔融氯化钠得到钠和氯气属于化学变化,可从海水中获得氯化镁,通过电解熔融的氯化镁得到镁和氯气属于化学变化,故②错误;
③电解饱和氯化钠溶液得到烧碱、氢气,有新物质生成属于化学变化,故③错误;
④把海水用蒸馏等方法可以得到淡水,把海水用太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故④正确;
故答案为:④;
(2)贝壳通过反应生成CaO,碳酸钙在高温下分解生成CaO,所以贝壳的主要成分是CaCO3;CaO和H2O反应生成Ca(OH)2,Ca(OH)2和镁离子反应生成Mg(OH)2,Mg(OH)2和HCl反应生成MgCl2,采用电解熔融氯化镁的方法制取Mg和氯气,
通过以上分析知,贝壳的主要成分是CaCO3;反应①为CaO和H2O反应生成Ca(OH)2,该反应为放热反应;
在熔融状态下电解氯化镁冶炼镁,电解反应方程式为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Cl2↑+Mg,
故答案为:CaCO3;放热;MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Cl2↑+Mg;
(3)氯气具有强氧化性,能和溴离子发生置换反应生成溴,离子方程式为:Cl2+2Br-=Br2+2Cl-,溴在有机溶剂中的溶解度大于在水中的溶解度,且有机溶剂和水不互溶,所以可以采用萃取的方法提取溴,
故答案为:Cl2+2Br-=Br2+2Cl-;萃取.
点评 本题考查了海水资源的综合利用,题目难度中等,根据化学反应的概念及流程图中物质的性质来分析解答,明确流程图中发生反应为解答关键,要求学生能够书写相应的化学方程式、掌握混合物分离的常见方法.

| A. | 8.64 g | B. | 9.00 g | C. | 9.20 g | D. | 9.44 g |
| A. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液 | |
| B. | 加入NaOH溶液加热,冷却后加入稀硝酸酸化,然后加入AgNO3溶液 | |
| C. | 在溴乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
| A. | 离子化合物一定只含离子键 | |
| B. | 共价化合物可能含有离子键 | |
| C. | 只含离子键的纯净物一定是离子化合物 | |
| D. | 只含共价键的纯净物一定是共价化合物 |
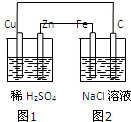
| A. | 装置中图1为原电池,图2为电解池 | |
| B. | 图2中Fe电极上的电极反应式为:2C1--2e一═C12↑ | |
| C. | 图1、图2溶液中的H+分别向Cu、Fe电极移动 | |
| D. | 该装置工作一段时间后,图1、图2溶液的pH均增大 |
| A. | 升高温度,正反应速率加快,逆反应速率减慢 | |
| B. | NO不可能全部转化为N2 | |
| C. | CO的转化率为最大值时,该反应达到平衡状态 | |
| D. | 单位时间内消耗NO和CO2的物质的量相等时,反应达到平衡状态 |
 四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示:
四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示: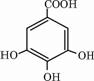 .
.