题目内容
10.理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用反应“Cu+2Ag+═2Ag+Cu2+”设计一个化学电池(正极材料用碳棒)(1)该电池的负极材料是Cu,电解质溶液是硝酸银溶液.
(2)该电池正极上发生的电极反应式为Ag++e-=Ag.
分析 (1)根据方程式,失电子的物质作负极;电解质溶液中含有得电子的Ag+;
(2)得电子的物质在正极上反应,结合方程式判断得电子的离子,从而写出电极反应式.
解答 解:(1)原电池中失电子的物质作负极,根据反应方程式知,Cu作负极,电解质溶液中含有得电子的Ag+,可用硝酸银溶液作电解质溶液,
故答案为:Cu;硝酸银溶液;
(2)在正极上银离子得电子生成银单质,电极反应式为Ag++e-=Ag,
故答案为:Ag++e-=Ag.
点评 本题考查原电池的设计,题目难度不大,注意两极材料的判断以及电极反应式的书写方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列有关实验的现象与对应结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有大量的水 |
| B | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有氧化性 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 淡黄色粉末变白 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |
18.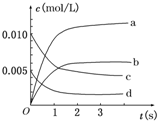 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
(1)用O2表示0~2s内该反应的平均速率v=0.0015mol/(L•s);
(2)图中a、b、c、d四条曲线中表示SO3浓度随时间变化的是b;
(3)恒温恒容条件下,能说明该反应已达到平衡状态的是BC.
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v逆(SO2)=2v正(O2) D.容器内密度保持不变.
 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中a、b、c、d四条曲线中表示SO3浓度随时间变化的是b;
(3)恒温恒容条件下,能说明该反应已达到平衡状态的是BC.
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v逆(SO2)=2v正(O2) D.容器内密度保持不变.
5.下列说法正确的是( )
| A. | 离子半径大小:F->Na+>Mg2+ | B. | 金属性强弱:K>Mg>Ca | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:LiOH>NaOH>KOH? |
15.如图是某只含有C、H、O、N的有机物简易球棍模型.下列关于该有机物的说法错误的是( )
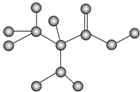

| A. | 该有机物的分子式为C3H7O2N | B. | 该有机物的名称为α氨基丙酸 | ||
| C. | 该有机物能发生加成反应 | D. | 该有机物分子之间能发生聚合反应 |
2.如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )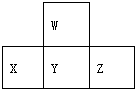

| A. | 元素X的最高价氧化物对应水化物的化学式为H3PO4 | |
| B. | 元素Y有2种氧化物且都能与元素W的氢化物反应生成对应价态的酸 | |
| C. | X、Y、Z各元素最高价和最低价的绝对值之和为8 | |
| D. | 原子半径的大小顺序是Z>Y>X>W |
19.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+11.9kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在25℃,101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
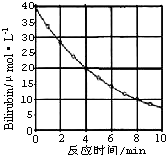 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算:
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算: