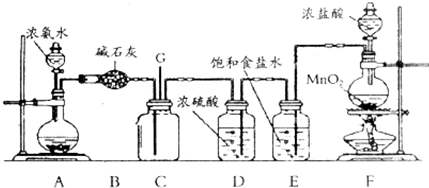
题目内容
18.太阳能的开发和利用是21世纪一个重要课题.利用储能介质储存太阳能的原理是:白天在太阳照射下某种盐熔化,吸收热量,晚间熔盐固化释放出相应的能量,已知数据:| 盐 | 熔点(℃) | 熔化吸热(kJ•mol-1) | 参考价格(元•t-1) |
| CaCl2•6H2O | 29.9 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 35.1 | 100.1 | 1 600~2 000 |
| Na2S2O3•5H2O | 45.0 | 49.7 | 1 400~1 800 |
| A. | CaCl2•6H2O | B. | Na2SO4•10H2O | C. | Na2HPO4•12H2O | D. | Na2S2O3•5H2O |
分析 根据表中信息判断哪种物质的熔点在40℃以下,并且单位质量的物质熔化时吸收的热量多等方面进行分析、考虑,从而得出正确的结论.
解答 解:选择的物质应该具有的特点是:在白天在太阳照射下,某种盐熔化,熔化时单位质量的物质吸收热量应该最多.同时价格不能太高,Na2SO4•10H2O的性价比最高,故选:B.
点评 本题主要考查了反应中的能量变化的原因,难度不大,需要强调的是能量高的物质性质不稳定,能量低的物质性质稳定.

练习册系列答案
相关题目
16.现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入几滴AgNO3溶液后有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
(4)第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
下列说法不正确的是( )
(1)第一份加入几滴AgNO3溶液后有沉淀产生;
(2)第二份加过量NaOH溶液加热后,只收集到气体0.03mol,无沉淀生成,同时得到溶液甲
(3)在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g
(4)第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
下列说法不正确的是( )
| A. | 步骤(3)后可以确定CO32-一定不存在 | |
| B. | 忽略步骤(1)对实验结论并无影响 | |
| C. | 不能确定原溶液是否含有K+和Cl- | |
| D. | 若把步骤(2)产生的气体通入步骤(1)的滤液中,又可产生0.78g沉淀 |
13. Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
(1)若由0.2mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH>7,则混合溶液中各种离子浓度由大到小的顺序是:c(Na+)>c(A-)>c(OH-)>c(H+).
(2)若HA为弱酸,现有两组溶液
A组:由0.4mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH<7;
B组:0.1mol/L的HA溶液
①A组溶液pH<7的原因:等浓度时弱酸HA电离大于A-离子水解.
②两组溶液中c(A-)的大小,A组>B组(填“>”“<”或“=”);溶液中水的电离程度A组>B组(填“>”“<”或“=”).
(3)若HA为强酸,若是pH=2HA V1mL与pH=12Ba(OH)2 V2 mL混合后得到pH=11的溶液,则$\frac{{V}_{1}}{{V}_{2}}$=$\frac{9}{11}$
Ⅱ、现有浓度为0.1mol•L-1的五种电解质溶液①NaHSO4;②NaHCO3;③NaCl;④CH3COONa;⑤NaOH
(1)这五种溶液的pH由小到大的顺序是①<③<④<②<⑤(填编号).
(2)在上述五种溶液中分别加入Al2(SO4)3溶液,能产生大量无色无味气体的是②(填编号);其离子反应方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑.
Ⅲ.已知:
(1)在浓度均为0.01mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01mol/L HCl,则体系中酸根离子反应的先后顺序为CO32-、ClO-、CH3COO-;(填酸根离子符号)
(2)25℃时,向20mL 0.1mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图象正确的是D.
 Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.(1)若由0.2mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH>7,则混合溶液中各种离子浓度由大到小的顺序是:c(Na+)>c(A-)>c(OH-)>c(H+).
(2)若HA为弱酸,现有两组溶液
A组:由0.4mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH<7;
B组:0.1mol/L的HA溶液
①A组溶液pH<7的原因:等浓度时弱酸HA电离大于A-离子水解.
②两组溶液中c(A-)的大小,A组>B组(填“>”“<”或“=”);溶液中水的电离程度A组>B组(填“>”“<”或“=”).
(3)若HA为强酸,若是pH=2HA V1mL与pH=12Ba(OH)2 V2 mL混合后得到pH=11的溶液,则$\frac{{V}_{1}}{{V}_{2}}$=$\frac{9}{11}$
Ⅱ、现有浓度为0.1mol•L-1的五种电解质溶液①NaHSO4;②NaHCO3;③NaCl;④CH3COONa;⑤NaOH
(1)这五种溶液的pH由小到大的顺序是①<③<④<②<⑤(填编号).
(2)在上述五种溶液中分别加入Al2(SO4)3溶液,能产生大量无色无味气体的是②(填编号);其离子反应方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑.
Ⅲ.已知:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
(2)25℃时,向20mL 0.1mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图象正确的是D.
3.下列叙述中正确的是( )
| A. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| B. | 金属晶体的熔点都比分子晶体的熔点高 | |
| C. | 金刚石的晶胞中含有4个碳原子 | |
| D. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
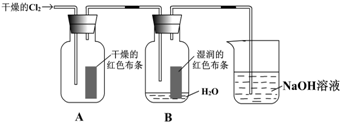
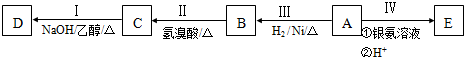
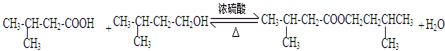 ;
; 、
、 ;
; .
. ;
;