题目内容
13. Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.(1)若由0.2mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH>7,则混合溶液中各种离子浓度由大到小的顺序是:c(Na+)>c(A-)>c(OH-)>c(H+).
(2)若HA为弱酸,现有两组溶液
A组:由0.4mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH<7;
B组:0.1mol/L的HA溶液
①A组溶液pH<7的原因:等浓度时弱酸HA电离大于A-离子水解.
②两组溶液中c(A-)的大小,A组>B组(填“>”“<”或“=”);溶液中水的电离程度A组>B组(填“>”“<”或“=”).
(3)若HA为强酸,若是pH=2HA V1mL与pH=12Ba(OH)2 V2 mL混合后得到pH=11的溶液,则$\frac{{V}_{1}}{{V}_{2}}$=$\frac{9}{11}$
Ⅱ、现有浓度为0.1mol•L-1的五种电解质溶液①NaHSO4;②NaHCO3;③NaCl;④CH3COONa;⑤NaOH
(1)这五种溶液的pH由小到大的顺序是①<③<④<②<⑤(填编号).
(2)在上述五种溶液中分别加入Al2(SO4)3溶液,能产生大量无色无味气体的是②(填编号);其离子反应方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑.
Ⅲ.已知:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
(2)25℃时,向20mL 0.1mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图象正确的是D.
分析 Ⅰ.(1)根据pH>7,则c(OH-)>c(H+)结合电荷守恒判断;
(2)①由0.4mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后反应得到混合溶液HA和NaA,根据等浓度时弱酸HA电离大于A-离子水解分析混合液的pH<7;
②A组溶液中是等浓度的HA和NaA,混合溶液中HA浓度0.1mol/L,NaA浓度为0.1mol/L,B组是0.1mol/L的HA溶液,两组溶液中c(A-)A组大;NaA溶液中A-抑制酸的电离,A-离子水解浓度减小,水的电离程度增大;
(3)根据混合后得到pH=11的溶液,则10-3=$\frac{10{\;}^{-2}×V{\;}_{2}-10{\;}^{-2}V{\;}_{1}}{V{\;}_{1}+V{\;}_{2}}$进行计算;
Ⅱ、(1)根据溶液的酸碱性以及利用盐类的水解程度来确定溶液中pH大小,酸的酸性越弱则酸的酸根离子水解程度越大,其相同浓度钠盐溶液的pH越大;
(2)碳酸氢根与铝离子发生双水解反应生成氢氧化铝沉淀与二氧化碳气体;
Ⅲ.(1)弱酸的酸性越弱,其酸根越易结合氢离子;
(2)A、根据0.1mol/L CH3COOH的pH值大于1判断;
B、△H与反应过程无关;
C、根据逐滴氢氧化钠溶液前,0.1mol/L CH3COOH溶液也具有导电性;
D、根据醋酸根随氢氧化钠的滴入逐渐增大,直到刚好完全反应,达到最大值.
解答 解:Ⅰ.(1)pH>7,则c(OH-)>c(H+),由电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)>c(A-),则溶液中应存在c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(2)①由0.4mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后反应得到混合溶液HA和NaA,混合溶液中HA浓度0.1mol/L,NaA浓度为0.1mol/L,因为等浓度时弱酸HA电离大于A-离子水解,所以混合液的pH<7;
故答案为:等浓度时弱酸HA电离大于A-离子水解;
②A组溶液中是等浓度的HA和NaA,混合溶液中HA浓度0.1mol/L,NaA浓度为0.1mol/L,B组是0.1mol/L的HA溶液,两组溶液中c(A-)A组大;NaA溶液中A-抑制酸的电离,A-离子水解浓度减小,水的电离程度增大;
故答案为:>;>;
(3)因为混合后得到pH=11的溶液,则10-3=$\frac{10{\;}^{-2}×V{\;}_{2}-10{\;}^{-2}V{\;}_{1}}{V{\;}_{1}+V{\;}_{2}}$,所以解得$\frac{{V}_{1}}{{V}_{2}}$=$\frac{9}{11}$,故答案为:$\frac{9}{11}$;
Ⅱ、(1):①硫酸氢钠是强酸酸式盐,硫酸氢根离子能完全电离生成氢离子,导致其溶液呈强酸性,pH<7;
②NaHCO3是强酸弱碱盐,碳酸氢根离子水解而使其溶液呈弱碱性,pH>7;
③氯化钠是强酸强碱盐,其溶液呈中性,pH=7;
④醋酸钠是强碱弱酸盐,其溶液呈碱性,pH>7,但由于醋酸的酸性比碳酸强,根据越弱越水解,所以同浓度的醋酸钠碱性比碳酸氢钠弱;
⑤氢氧化钠是强碱,其溶液呈强碱性,pH>7,相同浓度的氢氧化钠和醋酸钠、碳酸氢钠,氢氧化钠的pH大于醋酸钠、碳酸氢钠;
所以这几种溶液pH由小到大的顺序是①<③<④<②<⑤,故答案为:①<③<④<②<⑤;
(2)碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳,离子方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑;而NaHSO4、NaCl、CH3COONa与Al2(SO4)3不反应,NaOH与Al2(SO4)3反应生成氢氧化铝沉淀,
故答案为:②;3HCO3-+Al3+=Al(OH)3↓+3CO2↑;
Ⅲ.(1)弱酸的酸性越弱,其酸根越易结合氢离子,又根据弱酸的电离平衡常数可知弱酸的酸性大小顺序为HCO3-<HClO<CH3COOH,所以体系中酸根离子反应的先后顺序为CO32-、ClO-、CH3COO-,故答案为:CO32-、ClO-、CH3COO-;
(2)A、因为0.1mol/L CH3COOH的pH值大于1,所以图象起点错了,故A错误;
B、△H与反应过程无关,是一定值,故B错误;
C、因为逐入氢氧化钠溶液前,0.1mol/L CH3COOH溶液也具有导电性,所以图象起点错了,故C错误;
D、因为醋酸根随氢氧化钠的滴入逐渐增大,直到刚好完全反应,即滴加0.1mol/L NaOH溶液20ml时达到最大值,故D正确;
故选:D.
点评 本题主要考查了离子浓度的大小比较,pH值的计算,溶液酸碱性的比较以及据弱酸的电离平衡常数考查了其酸性相对强弱以及其酸根结合氢离子的能力,注意弱酸的酸性越弱,其酸根越易水解,题目难度较大.

| 盐 | 熔点(℃) | 熔化吸热(kJ•mol-1) | 参考价格(元•t-1) |
| CaCl2•6H2O | 29.9 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 35.1 | 100.1 | 1 600~2 000 |
| Na2S2O3•5H2O | 45.0 | 49.7 | 1 400~1 800 |
| A. | CaCl2•6H2O | B. | Na2SO4•10H2O | C. | Na2HPO4•12H2O | D. | Na2S2O3•5H2O |
| A. | 石油是混合物,其分馏产品汽油为纯净物 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 金属氧化物均为碱性氧化物 | |
| D. | “血液透析”利用了胶体的性质 |
| A. | 用水鉴别乙醇和苯 | |
| B. | 用碳酸氢钠溶液鉴别乙酸和乙醇 | |
| C. | 用新制的氢氧化铜悬浊液鉴别葡萄糖和蔗糖 | |
| D. | 用溴的四氯化碳溶液鉴别裂解气和焦炉气 |
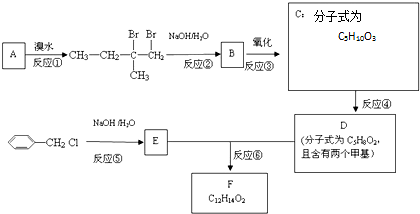
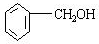 ;
;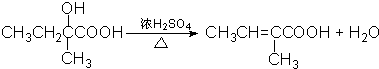 ;
;
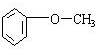 .
.