题目内容
5.W、X、Y、Z、Q、E是原子序数依次增大的短周期元素,W原子的最外层电子数是电子层数的2倍,Y、Z、E的最高价氧化物对应水化物可以两两反应生成盐和水,E的一种氧化物是常见大气污染物.Q原子的最外层有3个未成对电子.X是元素周期表中电负性最大的元素.(1)Y、Z各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为Al(OH)3+OH-=AlO2-+H2O.
(2)W与E可形成化合物WE2,该化合物的电子式为
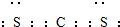 .
.(3)比较Q、E气态氢化物的稳定性:H2S>PH3(用分子式表示).
(4)X的氢化物水溶液中存在氢键,则可能存在的所有氢键类型共有4种.
(5)W元素可形成自然界硬度最大的单质M.M可在氧气中燃烧.请依据下列表格中所列出的化学键键能,写出M在氧气中充分燃烧的热化学反应方程式:C(s,金刚石)+O2(g)=CO2(g)△H=-306kJ/mol
| 键 | C-C | Cl-Cl | C=O | C-H | O=O |
| 键能/kJ/mol | 348 | 248 | 750 | 413 | 498 |
分析 W、X、Y、Z、Q、E是原子序数依次增大的短周期元素,X是元素周期表中电负性最大的元素,则X为F元素;W原子的最外层电子数是电子层数的2倍,则W为C元素(不考虑He);由原子序数可知,Y、Z、Q、E均处于第三周期,Y、Z、E的最高价氧化物对应水化物可以两两反应生成盐和水,应是氢氧化铝、强碱、强酸之间的反应,故Y为Na、Z为Al,E的一种氧化物是常见大气污染物,则E为S;Q原子的最外层有3个未成对电子,则Q为P元素,据此解答.
解答 解:W、X、Y、Z、Q、E是原子序数依次增大的短周期元素,X是元素周期表中电负性最大的元素,则X为F元素;W原子的最外层电子数是电子层数的2倍,则W为C元素(不考虑He);由原子序数可知,Y、Z、Q、E均处于第三周期,Y、Z、E的最高价氧化物对应水化物可以两两反应生成盐和水,应是氢氧化铝、强碱、强酸之间的反应,故Y为Na、Z为Al,E的一种氧化物是常见大气污染物,则E为S;Q原子的最外层有3个未成对电子,则Q为P元素.
(1)Y、Z各自的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应离子方程式为:Al(OH)3+OH-=AlO2-+H2O,
故答案为:Al(OH)3+OH-=AlO2-+H2O;
(2)W与E可形成化合物WE2为CS2,与二氧化碳结构类似,该化合物的电子式为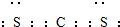 ,故答案为:
,故答案为: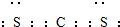 ;
;
(3)非金属性S>P,故氢化物稳定性:H2S>PH3,故答案为:H2S>PH3;
(4)X的氢化物为HF,水溶液中存在氢键有:H-F…F、H-F…H-O、H-O…H-O、H-O…H-F,共有4种氢键,故答案为:4;
(5)发生反应:C(s,金刚石)+O2(g)=CO2(g),金刚石中每个C原子形成4个C-C键,每个C-C键为每个碳原子提供$\frac{1}{2}$,故1mol金刚石中含有2molC-C键,反应热△H=2mol×348kJ/mol+498kJ/mol-2×750kJ/mol=-306kJ/mol,故热化学方程式为:C(s,金刚石)+O2(g)=CO2(g)△H=-306kJ/mol,
故答案为:C(s,金刚石)+O2(g)=CO2(g)△H=-306kJ/mol.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意理解HF水溶液中氢键,(5)为易错点,理解金刚石晶胞结构,利用均摊法计算金刚石中共价键数目,难度中等.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | Na2SiO3溶液与盐酸 | B. | CO2与足量石灰水 | ||
| C. | NaOH溶液与NaAlO2溶液 | D. | NaOH溶液与NaHCO3溶液 |
| A. |  稀硫酸 | B. | 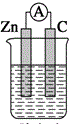 稀硫酸 | C. | 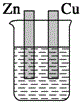 稀硫酸 | D. | 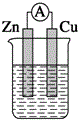 无水乙醇 |
| A. | 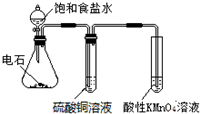 目的:验证乙炔的还原性 | |
| B. | 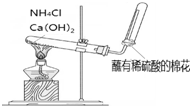 目的:收集氨气 | |
| C. | 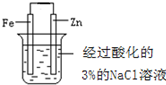 操作:片刻后在Fe电极附近滴入 K3[Fe(CN)6]溶液,目的:验证Fe电极被保护 | |
| D. |  操作:①加入3滴同浓度的AgNO3溶液、②再加入3滴同浓度的Na2S溶液,目的:验证AgCl的溶解度大于Ag2S |
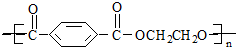
| A. | 羊毛与聚酯纤维的化学成分相同 | |
| B. | 聚酯纤维和羊毛在一定条件下均能水解 | |
| C. | 该聚酯纤维的单体为对苯二甲酸和乙醇 | |
| D. | 聚酯纤维属于纯净物 |
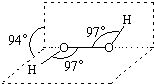 过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )
过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )| A. | 过氧化氢分子中存在离子键、共价键 | |
| B. | 在1.00mol H2O2中,核外电子总数为10×6.02×1023个 | |
| C. | 过氧化氢既有氧化性又有还原性 | |
| D. | 3.4g过氧化氢中含有6.02×1022个原子 |
| A. | CH3-CH3 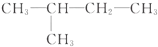 | B. | CH2═CH-CH3,CH2═CH-CH2-CH3 | ||
| C. | CH3-CH2-OH,CH3-CH2-CH2-CH3 | D. | 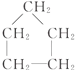 , ,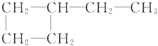 |
| 现 象 | 解 释 | |
| A | Na2O2 投入到 FeCl2 溶液中得到大量红褐色沉淀 | Na2O2 具有还原性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |