题目内容
10.纯羊毛线和聚酯纤维(结构如图)均是纺织、服装行业常用的材料.下列说法正确的是( )
| A. | 羊毛与聚酯纤维的化学成分相同 | |
| B. | 聚酯纤维和羊毛在一定条件下均能水解 | |
| C. | 该聚酯纤维的单体为对苯二甲酸和乙醇 | |
| D. | 聚酯纤维属于纯净物 |
分析 A.可根据合成材料和人造纤维的制法原理进行分析.
B.聚酯纤维链节中含有酯基,羊毛是动物纤维,主要成份是蛋白质.
C.链节中含有酯基结构的高聚物,按酯基中碳氧单键断裂,羰基上加羟基,氧原子上加氢原子即得高聚物单体.
D.聚酯纤维为高分子化合物,属于混合物.
解答 解:A.羊毛是动物纤维,主要成份是蛋白质,属于天然有机高分子材料(天然纤维).而聚酯纤维是由乙二醇(HO-CH2-CH2-OH)和对苯二甲酸(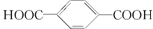 )通过缩聚形成的,所以其化学成分不同,故A错误;
)通过缩聚形成的,所以其化学成分不同,故A错误;
B.聚酯纤维链节中含有酯基,可以发生水解.羊毛是动物纤维,主要成份是蛋白质,分子中存在肽键,也可以水解,故B正确;
C.链节中含有酯基,聚酯纤维是由乙二醇(HO-CH2-CH2-OH)和对苯二甲酸( )通过缩聚形成的,故C错误;
)通过缩聚形成的,故C错误;
D.聚酯纤维为高分子化合物,其分子中n不能确定,所以为混合物,故D错误;
故选B.
点评 本题考查常用合成高分子材料的化学成分及其性质,题目难度不大,明确常见有机物结构与性质为解答关键,注意高分子化合物都为混合物,为易错点.

练习册系列答案
相关题目
8.在150℃时碳酸铵可以受热完全分解,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍( )
| A. | 96倍 | B. | 48倍 | C. | 12倍 | D. | 32倍 |
1.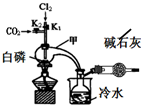 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.
实验室制取PCl3的装置示意图和有关数据如下:
请回答:
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶和分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是先打开K2,等反应体系中充满CO2后,加入白磷,然后再打开K1,通入氯气,加热.
(3)E烧杯中加入冷水的目的是冷却收集PCl3,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)(已知亚磷酸(H3PO3)是二元弱酸).
②若将0.01mol POCl3投入热水配成1L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.
实验室制取PCl3的装置示意图和有关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶和分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是先打开K2,等反应体系中充满CO2后,加入白磷,然后再打开K1,通入氯气,加热.
(3)E烧杯中加入冷水的目的是冷却收集PCl3,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)(已知亚磷酸(H3PO3)是二元弱酸).
②若将0.01mol POCl3投入热水配成1L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
18.下列同组的化合物,一定属于同系物的是( )
| A. | 甲酸与油酸 | B. | 乙二醇与丙三醇 | ||
| C. | C2H2和C4H6 | D. | 甲酸甲酯与乙酸乙酯 |
15.已知2mol氢气完全燃烧生成水蒸气时放出能量484kJ,且氧气中1mol O=O键完全断裂时吸收能量496kJ,水蒸气中1mol H-O键形成时放出能量463kJ,则氢气中1mol H-H键断裂时吸收能量为( )
| A. | 920kJ | B. | 557kJ | C. | 188kJ | D. | 436kJ |
19.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液 | |
| C. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 | |
| D. | 苯(苯酚):加氢氧化钠溶液,充分振荡,分液,弃去下层液体 |
20.部分短周期主族元素的原子半径数据如下表:
根据上表信息,判断下列说法正确的是( )
| 元素 | W | Q | M | R | X | Y |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.102 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 原子半径:Y<M<Q,所以原子序数:Y>M>Q | |
| B. | M、Q、W都是金属,且其单质与盐酸反应的速率:M>Q>W | |
| C. | Q2+与X2-的电子层结构相同,且X2-离子半径大于Q2+ | |
| D. | M的氧化物能与W的最高价氧化物的水化物反应 |
 .
. 某同学通过如下实验,探究化学反应中的能量变化.
某同学通过如下实验,探究化学反应中的能量变化. ,用湿润的红色石蕊试纸检验该气体.
,用湿润的红色石蕊试纸检验该气体.