题目内容
3.已知转化率=$\frac{n(转化量)}{n(起始量)}$×100%.在一定温度下,将1.0mol CH4和2.0mol H2O(g)通入某一恒压容器中,达到化学平衡时,混合气体共有4.0mol,则CH4的转化率为50%(写出简要计算过程)分析 依据化学平衡三段式列式计算,设达到平衡消耗甲烷物质的量为x
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol) 1 2 0 0
变化量(mol) x x x 3x
平衡量(mol) 1-x 2-x x 3x
1-x+2-x+x+3x=4
x=0.5
结合转化率=$\frac{消耗量}{起始量}$×100%得到.
解答 解:设达到平衡消耗甲烷物质的量为x,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol) 1 2 0 0
变化量(mol) x x x 3x
平衡量(mol) 1-x 2-x x 3x
1-x+2-x+x+3x=4
x=0.5
结合转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.5mol}{1.0mol}$×100%=50%,
故答案为:50%.
点评 本题考查了化学平衡的三段式计算方法和转化率的概念计算应用,掌握基础是关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列能用勒夏特列原理解释的是( )
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
14.化学在生产和生活中有着广泛的应用.下列说法错误的是( )
| A. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜的要求 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代常用的一次性饭盒,可防止产生白色污染 | |
| C. | 蛋白质、淀粉、纤维素这些生活中的常见物质都是天然高分子化合物 | |
| D. | 煤经气化和液化两个物理过程,可变为清洁能源 |
18.下列各组离子能在溶液中大量共存的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、H+、CO32-、Cl- | ||
| C. | Na+、Ca2+、NO3-、CO32- | D. | Na+、K+、Cl-、SO42- |
8.在150℃时碳酸铵可以受热完全分解,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍( )
| A. | 96倍 | B. | 48倍 | C. | 12倍 | D. | 32倍 |
15.己烯雌酚是一种激素类药物,结构如图,下列有关叙述中正确的是( )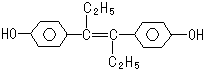

| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 1mol该有机物可以与5mol Br2发生反应 | |
| C. | 可分别与NaOH和NaHCO3发生反应 | |
| D. | 该有机物分子中,所有原子可能共平面 |
 将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答: .
.