题目内容
17.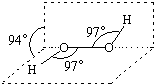 过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )
过氧化氢被称为绿色氧化剂,它的分子结构如图所示.已知该分子H-O-O键角都是97°.下列有关H2O2的说法正确的是( )| A. | 过氧化氢分子中存在离子键、共价键 | |
| B. | 在1.00mol H2O2中,核外电子总数为10×6.02×1023个 | |
| C. | 过氧化氢既有氧化性又有还原性 | |
| D. | 3.4g过氧化氢中含有6.02×1022个原子 |
分析 A.一般活泼金属与活泼非金属元素间形成离子键,非金属元素间形成共价键;
B.一个过氧化氢分子中含有18个电子;
C.根据过氧化氢中O元素的化合价判断;
D.根据n=$\frac{m}{M}$和N=nNA计算.
解答 解:A.过氧化氢分子中存在O-O键和O-H键,没有离子键,故A错误;
B.一个过氧化氢分子中含有18个电子,则在1.00mol H2O2中,核外电子总数为18×6.02×1023个,故B错误;
C.H2O2中O元素的化合价为-1价,为中间价态,所以过氧化氢既有氧化性又有还原性,故C正确;
D.3.4g过氧化氢中分子的物质的量为n=$\frac{m}{M}$=$\frac{3.4g}{34g/mol}$=0.1mol,则原子的物质的量为0.4mol,所以N=nNA=0.4×6.02×1023个原子,故D错误.
故选C.
点评 本题考查了共价键、离子键、氧化还原反应以及物质的量的计算,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
15.己烯雌酚是一种激素类药物,结构如图,下列有关叙述中正确的是( )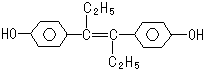

| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 1mol该有机物可以与5mol Br2发生反应 | |
| C. | 可分别与NaOH和NaHCO3发生反应 | |
| D. | 该有机物分子中,所有原子可能共平面 |
8.下列各组物质中属于同分异构体的是( )
| A. | H2O和D2O | B. | O2和O3 | ||
| C. | CH3CH2OH和CH3-O-CH3 | D. | 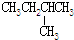 和 和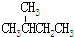 |
12.下列说法正确的是( )
| A. | 按系统命名法,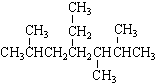 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次升高 | |
| C. | “糖类”物质均具有明显的甜味 | |
| D. | 1mol的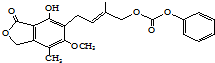 最多能与含5mol NaOH的水溶液完全反应 最多能与含5mol NaOH的水溶液完全反应 |
6.工厂经常用浓氯水检验管道是否漏氯气,其反应为:3Cl2+8NH3═6NH4Cl+N2,如果观察到产生白烟现象,则说明管道漏气.关于该反应的有关判断错误的( )
| A. | 该反应属于置换反应 | B. | 该反应的还原剂是NH3 | ||
| C. | Cl2的氧化性小于N2 | D. | 被氧化的NH3占参加反应NH3的1/4 |
7.下列各组离子在溶液中按照一定个数比混合所得溶液为无色透明且呈中性的是( )
| A. | Na+Fe3+ Cl-NO3- (1:1:3:1) | |
| B. | Ca2+ K+ OH- HCO3- (1:1:2:1) | |
| C. | H+ SO42- OH- Ba2+ (2:1:2:1) | |
| D. | Na+ PO43- H+ SO42- (2:1:3:1) |
 .
. 某同学通过如下实验,探究化学反应中的能量变化.
某同学通过如下实验,探究化学反应中的能量变化. ,用湿润的红色石蕊试纸检验该气体.
,用湿润的红色石蕊试纸检验该气体.