题目内容
13.下列装置能构成原电池的是( )| A. | 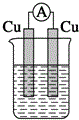 稀硫酸 | B. | 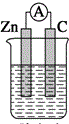 稀硫酸 | C. | 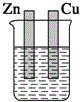 稀硫酸 | D. | 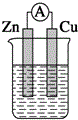 无水乙醇 |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:A、两个电极材料相同,所以不能构成原电池,故A错误;
B、两电极材料不同,锌较活泼能和稀硫酸能自发的进行氧化还原反应,且构成了闭合回路,所以能构成原电池,故B正确;
C、未构成闭合回路,所以不能构成原电池,故C错误;
D、无水乙醇是非电解质,所以不能构成原电池,故D错误;
故选B.
点评 本题考查了原电池的构成条件,难度不大,注意这几个条件必须同时存在才能形成原电池,缺一不可.

练习册系列答案
相关题目
1.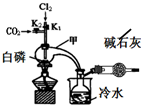 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.
实验室制取PCl3的装置示意图和有关数据如下:
请回答:
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶和分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是先打开K2,等反应体系中充满CO2后,加入白磷,然后再打开K1,通入氯气,加热.
(3)E烧杯中加入冷水的目的是冷却收集PCl3,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)(已知亚磷酸(H3PO3)是二元弱酸).
②若将0.01mol POCl3投入热水配成1L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.
实验室制取PCl3的装置示意图和有关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶和分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是先打开K2,等反应体系中充满CO2后,加入白磷,然后再打开K1,通入氯气,加热.
(3)E烧杯中加入冷水的目的是冷却收集PCl3,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)(已知亚磷酸(H3PO3)是二元弱酸).
②若将0.01mol POCl3投入热水配成1L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
8.下列各组物质中属于同分异构体的是( )
| A. | H2O和D2O | B. | O2和O3 | ||
| C. | CH3CH2OH和CH3-O-CH3 | D. | 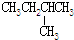 和 和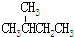 |
18.下列同组的化合物,一定属于同系物的是( )
| A. | 甲酸与油酸 | B. | 乙二醇与丙三醇 | ||
| C. | C2H2和C4H6 | D. | 甲酸甲酯与乙酸乙酯 |
3.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:C钠,E氯
(2)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)O2->Mg2+>Al3+
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式Cl2+2OH-=Cl-+ClO-+H2O
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)用电子式表示C2B的形成过程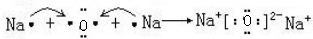 .
.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C钠,E氯
(2)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)O2->Mg2+>Al3+
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式Cl2+2OH-=Cl-+ClO-+H2O
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)用电子式表示C2B的形成过程
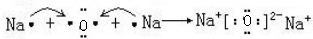 .
.  将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答: .
. 某同学通过如下实验,探究化学反应中的能量变化.
某同学通过如下实验,探究化学反应中的能量变化. ,用湿润的红色石蕊试纸检验该气体.
,用湿润的红色石蕊试纸检验该气体.