题目内容
15.对下列实验现象的解释正确的是( )| 现 象 | 解 释 | |
| A | Na2O2 投入到 FeCl2 溶液中得到大量红褐色沉淀 | Na2O2 具有还原性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、过氧化钠、具有氧化性;
B、浓硝酸分解生成二氧化氮气体溶解于硝酸呈黄色;
C、亚硫酸根离子在硝酸酸化的溶液中被氧化为硫酸根离子,也会出现此现象;
D、浓硫酸具有吸水性,且稀释浓硫酸会放出大量热,氯化氢具有挥发性,温度越高,其挥发性越强.
解答 解:A、Na2O2 投入到 FeCl2 溶液中得到大量红褐色沉淀,是因为过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠和氯化亚铁反应生成氢氧化亚铁被氧气氧化得到氢氧化铁红褐色沉淀,是过氧化钠的氧化性,故A错误;
B、浓硝酸不稳定,浓硝酸分解生成二氧化氮气体溶解于硝酸呈黄色,生成的有色产物能溶于浓硝酸正确,故B正确;
C、亚硫酸根离子在硝酸酸化的溶液中被氧化为硫酸根离子,也会出现此现象,不能证明一定含有硫酸根离子,故C错误;
D、浓硫酸具有吸水性,向盐酸中加入浓硫酸时产生白雾,相当于稀释浓硫酸,稀释浓硫酸时放出大量热,盐酸具有挥发性,且温度越高,其挥发性越强,浓硫酸放出的热量导致氯化氢的挥发性增强,氯化氢遇空气中水蒸气形成盐酸小液滴而产生白雾,与脱水性无关,故D错误;
故选B.
点评 本题考查了物质性质的分析判断,主要是离子检验方法,物质特征反应现象分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
6.工厂经常用浓氯水检验管道是否漏氯气,其反应为:3Cl2+8NH3═6NH4Cl+N2,如果观察到产生白烟现象,则说明管道漏气.关于该反应的有关判断错误的( )
| A. | 该反应属于置换反应 | B. | 该反应的还原剂是NH3 | ||
| C. | Cl2的氧化性小于N2 | D. | 被氧化的NH3占参加反应NH3的1/4 |
3.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:C钠,E氯
(2)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)O2->Mg2+>Al3+
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式Cl2+2OH-=Cl-+ClO-+H2O
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)用电子式表示C2B的形成过程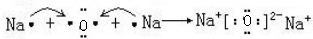 .
.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C钠,E氯
(2)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)O2->Mg2+>Al3+
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式Cl2+2OH-=Cl-+ClO-+H2O
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)用电子式表示C2B的形成过程
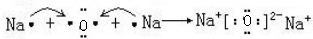 .
.
10.阿伏伽德罗常数约为6.02×1023mol-1,下列叙述中不正确的是( )
| A. | 0.1 mol OH-含有6.02×1023个电子 | |
| B. | 氯化氢气体的摩尔质量等于6.02×1023氯气分子和6.02×1023个氢分子的质量之和 | |
| C. | 1 mol醋酸的质量与6.02×1023个醋酸分子的质量相等 | |
| D. | 28 g氮气所含的原子数目为12.04×1023 |
20.部分短周期主族元素的原子半径数据如下表:
根据上表信息,判断下列说法正确的是( )
| 元素 | W | Q | M | R | X | Y |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.102 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 原子半径:Y<M<Q,所以原子序数:Y>M>Q | |
| B. | M、Q、W都是金属,且其单质与盐酸反应的速率:M>Q>W | |
| C. | Q2+与X2-的电子层结构相同,且X2-离子半径大于Q2+ | |
| D. | M的氧化物能与W的最高价氧化物的水化物反应 |
7.下列各组离子在溶液中按照一定个数比混合所得溶液为无色透明且呈中性的是( )
| A. | Na+Fe3+ Cl-NO3- (1:1:3:1) | |
| B. | Ca2+ K+ OH- HCO3- (1:1:2:1) | |
| C. | H+ SO42- OH- Ba2+ (2:1:2:1) | |
| D. | Na+ PO43- H+ SO42- (2:1:3:1) |
4.下列关于化学用语的表示正确的是( )
| A. | 过氧化钠的电子式: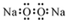 | B. | 中子数为 20 的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | 硫离子的结构示意图: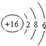 | D. | HCN的结构式:H-C≡N |
5.某混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、CO32-、SO42-,现每次取100mL溶液分别进行下列实验:下列说法正确的是( )
| 实验编号 | 实验步骤 | 实验现象 |
| ② | 加入AgNO3溶液 | 有沉淀产生 |
| ③ | 加入足量NaOH溶液后加热 | 收集气体0.896L(标准状况) |
| ④ | 加入足量的BaCl2 溶液 | 得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33g |
| A. | c(K+)≥0.2 mol/L | |
| B. | 一定存在的离子:Cl-、NH4+、CO32-、SO42- | |
| C. | 一定不存在的离子:Ca2+、K+、Cl- | |
| D. | c(K+)+c(NH4+)=c(CO32-)+c(SO42-) |
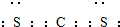 .
.