题目内容
18.下列事实,不能用勒夏特列原理解释的是( )| A. | 打开啤酒瓶后,瓶中立即泛起大量泡沫 | |
| B. | 工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g),选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| C. | 在溴水中存在如下平衡:Br2+H2O?HBr+HBrO,当加入NaOH溶液后,颜色变浅 | |
| D. | 对于2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.气体的溶解度随温度的升高而减小,随压强的增大而增大,由气体的溶解度随压强的增大而增大,因此常温时打开汽水瓶时,瓶内的压强减小,因此瓶内的二氧化碳会从瓶中溢出,可以用勒夏特列原理解释,故A不选;
B.由于K为气态,将钾分离出来,降低了产物的浓度,平衡正向移动,能用勒夏特列原理解释,故B不选;
C.加入氢氧化钠后,氢氧化钠和酸反应生成盐和水促进溴和水反应,所以溶液颜色变浅,能用勒夏特列原理解释,故C不选;
D.增大压强,平衡不移动,但体积减小导致碘浓度增大,颜色变深,所以不能用勒夏特里原理解释,故D选;
故选D.
点评 本题考查化学平衡移动原理,明确平衡移动原理内涵及适用范围是解本题关键,易错选项是D,注意只有改变条件时平衡发生移动才能用平衡移动原理解释,否则不能解释.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
6.汽车尾气中NO,是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体中的血管内又有传送信息的功能,下列有关NO的说法正确的是( )
| A. | NO是一种红棕色气体,易溶于水 | |
| B. | 汽车尾气中NO的来源是空气中的N2与O2在汽车气缸内的高温环境下的反应产物 | |
| C. | 工业生产硝酸的原料主要有NO和空气 | |
| D. | 由于NO在血管中的特殊作用,所以NO无毒 |
3.下列说法正确的是( )
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
10.反应2S02(g)+O2?2SO3(g)△H<0,下列措施能提高S02转化率的是( )
| A. | 增大S02的浓度 | B. | 提高O2与SO2的体积比 | ||
| C. | 减小压强 | D. | 升高温度 |
7.铊元素位于元素周期表第6周期ⅢA族.下面关于铊元素性质的说法不正确的是( )
| A. | 氢氧化铊是两性氢氧化物 | |
| B. | 在化合物中呈+3价 | |
| C. | 单质铊与同浓度的盐酸反应比铝剧烈 | |
| D. | 铊的还原性比铝的强 |
8.金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能,电镀废水中六价铬具有高毒性,必须经处理后才能排放.
(1)常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①镀铬液在水溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+该反应平衡常数表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$.
②镀铬时由CrO42-放电产生铬镀层.阴极的电极反应式为CrO42-+8H++6e-=Cr+4H2O.
③ABS塑料表面经处理后也可在其表面镀铬,ABS塑料的结构简式如下:
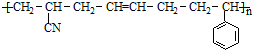 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和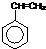 (写结构简式).
(写结构简式).
(2)工业上处理含铬废水有钡盐法、电解还原法等.
Ⅰ.钡盐法处理含铬废水主要流程为:
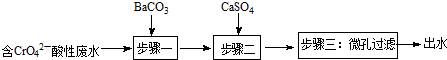
已知:
①步骤一发生的反应之一为:CrO42-+BaCO3═BaCrO4+CO32-,可推知:Ksp(BaCrO4)<Ksp(BaCO3)(选填:“>”或“<”);
②步骤二的目的是除去废水中Ba2+.
Ⅱ.电解法处理含六价铬(Cr2O72-和CrO42-)的强酸性废水,其原理如图所示.

③电解一段时间后随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.图中A为电源正极(选填:“正”或“负”);
④阴极产生的气体为H2(写化学式).
⑤常温时Ksp[Cr(OH)3]=6.0×10-31,当废水的pH=7.0时,溶液中c(Cr3+)=6.0×10-10mol•L-1.
(1)常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①镀铬液在水溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+该反应平衡常数表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$.
②镀铬时由CrO42-放电产生铬镀层.阴极的电极反应式为CrO42-+8H++6e-=Cr+4H2O.
③ABS塑料表面经处理后也可在其表面镀铬,ABS塑料的结构简式如下:
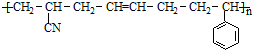 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和 (写结构简式).
(写结构简式).(2)工业上处理含铬废水有钡盐法、电解还原法等.
Ⅰ.钡盐法处理含铬废水主要流程为:

已知:
| 物质 | BaCO3 | CaSO4 | BaSO4 |
| Ksp | 8.1×10-9 | 9×10-6 | 1.1×10-10 |
②步骤二的目的是除去废水中Ba2+.
Ⅱ.电解法处理含六价铬(Cr2O72-和CrO42-)的强酸性废水,其原理如图所示.

③电解一段时间后随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.图中A为电源正极(选填:“正”或“负”);
④阴极产生的气体为H2(写化学式).
⑤常温时Ksp[Cr(OH)3]=6.0×10-31,当废水的pH=7.0时,溶液中c(Cr3+)=6.0×10-10mol•L-1.
 ;
;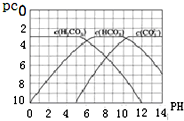 pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图.
pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图. H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.
H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.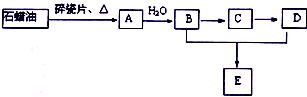 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略).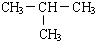 ;
;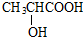 ,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.
,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.