��Ŀ����
����Ŀ���鼰�仯�����ڰ뵼�塢ũҩ����ȷ�����;�dz��㷺���ش��������⣺
��1��AsH3�ĵ���ʽΪ___��
��2���ı�0.1mol��L-1��Ԫ����H3AsO4��Һ��pH����Һ�е�H3AsO4��H2AsO4-��HAsO42-��AsO43-�����ʵ����ֲ�������pH�ı仯��ͼ��ʾ��

��lgKa1(H3AsO4)=_____��
���ü�����ָʾ������NaOH��Һ�ζ�H3AsO4��������Ҫ��Ӧ�����ӷ���ʽΪ___��
��3����̿���ұ����ʱ�������������в����Ȼ�ѧ��Ӧ���£�
��Ӧ��As2O3(g)+3C(s)![]() 2As(g)+3CO(g) ��H1=akJ��mol-1
2As(g)+3CO(g) ��H1=akJ��mol-1
��Ӧ��As2O3(g)+3C(s)![]()
![]() As4(g)+3CO(g) ��H2=bkJ��mol-1
As4(g)+3CO(g) ��H2=bkJ��mol-1
��Ӧ��As4(g)![]() 4As(g) ��H
4As(g) ��H
����H=____kJ��mol-1���ú�a��b�Ĵ���ʽ��ʾ����
�ڷ�Ӧ�д����Ļ��Ի���Ϊ������Ӧ������As4�������ͣ�ͬʱ���ڵķ�Ӧ��ʹAs4�����١�����������±���
��Ӧ�� | ��Ӧ�� | ||
��ܣ�kJ��mol-1�� | ����X | 56 | 75 |
����Y | 37 | 97 | |
���ϱ��жϴ���X____������������������������Y��������_____��
��4����Ӧ2As2S3(s)![]() 4AsS(g)+S2(g)��ƽ��ʱ������ѹ�Ķ���ֵlg��p/kPa�����¶ȵĹ�ϵ��ͼ��ʾ��
4AsS(g)+S2(g)��ƽ��ʱ������ѹ�Ķ���ֵlg��p/kPa�����¶ȵĹ�ϵ��ͼ��ʾ��

�ٶ�Ӧ�¶��£�B��ķ�Ӧ����v������_____v���棩������>����<������=������
��A�㴦��AsS(g)�ķ�ѹΪ____kPa���÷�Ӧ��Kp=_____kPa5��KpΪ�Է�ѹ��ʾ��ƽ�ⳣ������
���𰸡�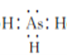 -2.2 H3AsO4+OH-�TH2AsO4-+H2O 2a-2b ���� ����ڴ���Y��ʹ�ô���Xʱ����Ӧ������As4���Ļ�ܸ�������As4�ķ�Ӧ����С������Ӧ������Խ�С������As4�ķ�Ӧ���ʴ� > 0.8 8.192��10-2
-2.2 H3AsO4+OH-�TH2AsO4-+H2O 2a-2b ���� ����ڴ���Y��ʹ�ô���Xʱ����Ӧ������As4���Ļ�ܸ�������As4�ķ�Ӧ����С������Ӧ������Խ�С������As4�ķ�Ӧ���ʴ� > 0.8 8.192��10-2
��������
��1����ΪAs��Nλ��ͬ���壬AsH3��NH3�ĵ���ʽ���ƣ���AsH3�ĵ���ʽΪ ��
��
��2����H3AsO4![]() H2AsO4����H����Ka1=
H2AsO4����H����Ka1=![]() ������ͼ��c(H2AsO4��)=c(H3AsO4)ʱ����Һ��pH=2.2����Ka1=c(H��)=10��2.2����pKa1=��2.2��
������ͼ��c(H2AsO4��)=c(H3AsO4)ʱ����Һ��pH=2.2����Ka1=c(H��)=10��2.2����pKa1=��2.2��
�ڼ��ȵı�ɫ��Χ��3.1��4.4����Һ�����ԣ�����ͼ���ü�����ָʾ�����ζ����յ���Һ��ɫ�仯�Ǻ�ɫ��Ϊ��ɫ��������������Ʒ�Ӧ�����ӷ���ʽΪH3PO4��OH��=H2PO4����H2O��
��3���ٷ�Ӧ��=��ӦI��2����Ӧ���2������H=(2a��2b)kJ��mol��1��
�ڴ������ͻ�ܣ����ԽС����Ӧ����Խ�죬�Աȱ������ݣ�����ڴ���Y��ʹ�ô���Xʱ����Ӧ��������As4���Ļ�ܸ�������As4�ķ�Ӧ����С������Ӧ�������Խ�С������As4�ķ�Ӧ���ʴ���˴���X���ڴ���Y��
��4���ٸ���ͼ��ͼ����������Ϊƽ���ߣ����ݷ�Ӧ����ʽ��B��ﵽA�㣬������ѹ�Ķ���ֵ����˵����Ӧ������Ӧ������У���v(��)>v(��)��
��A��������ѹΪ1kPa����ѹ������ѹ������������ʵ�����������AsS(g)�ķ�ѹΪ1kPa��4/5=0.8kPa��S2(g)�ķ�ѹΪ1kPa��1/5=0.2kPa��Kp=p4(AsS)��p(S2)=(0.8)4��0.2=8.192��10��2��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
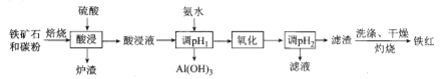
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij��������Ҫ�����ᡢFe3+��Fe2+��TiO2+��Al3+ �����ø÷�Һ�Ʊ����������[( NH4) 2S2O8]��TiO2��һ�ֹ�����������:

��֪��i.TiOSO4����ˮ����ˮ������H2TiO3,��������γ��������������pH��Χ�� �±�:
�������� | TiO2+ | Fe3+ | Fe2+ | Al3+ |
��ʼ������pH | 1.2 | 1.9 | 7.0 | 3.2 |
������ȫ��pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 ʱ,Fe2+�������� Fe( ��)������Fe(NH3)2]2+o
��ش���������:
(1)��������Fe��������________________ .
(2)����TiO(OH)2�Ļ�ѧ����ʽΪ_______________ ��
(3)����I������II�����е����ʵĻ�ѧʽΪ_____________ .
(4)����H2O2��Ŀ���dz���Fe( ��)��������[Fe(NH3)2]2+,�˹������������뻹ԭ�������ʵ���֮�������ϵ���________ (����ֵ)��
(5)�����£���������Ҫ������ʽ��pH�Ĺ�ϵ����ͼ��ʾ��

��Pt�缫��ⱥ��NH4HSO4��Һ�Ʊ����������ʱ��Ϊ�����������ŵ��������ҪΪ HSO4-��Ӧ������������Һ��pH��Χ��______֮��,��缫��ӦʽΪ____________ ��
(6)������Ա�����������[NH4Fe(SO4)2]�ζ����ⶨTiO2�Ĵ��ȣ��䲽��Ϊ�� ���������ܽ�wg ����������Ʒ������������ԭ�������ˡ�ϴ�ӣ�����Һ����Ϊ100 mL,ȡ 25.00 mL,��NH4SCN��ָʾ�����ñ����������Һ�ζ����յ㣬��Ӧԭ��Ϊ: Ti3++Fe3+=Ti4++Fe2+��
���жϵζ��յ�ķ�����________________________ ��
�ڵζ��յ�ʱ����c mol/L-1 NH4Fe(SO4)2��ҺVmL,��TiO2����Ϊ___________(д�������ĸ��ʾ�Ĵ���ʽ)��
����Ŀ���±��е�ʵ��������ܴﵽʵ��Ŀ�Ļ�ó���Ӧ���۵���
ѡ�� | ʵ����� | ʵ��Ŀ�Ļ���� |
A | ��ͬpH��ͬ����Ĵ����������Һ�м�������þ�ۣ���ȫ��Ӧ���ռ�H2����� | �Ƚ�������ĵ���̶� |
B | ������Ca(OH)2���ʵ� Mg(OH)2��Ʒ����ˮ�У����裬�ɽ�״���ټ��뱥��MgCl2��Һ����ֽ������ˣ�������ˮϴ�������� | ��ȥMg(OH)2��Ʒ�е�Ca(OH)2���� |
C | ��ʢ��1mL0.01mol/LAgNO3��Һ���Թ��еμ�5��0.01mol/L NaCl��Һ���а�ɫ�������ɣ��ٵμ�0.01mol/L NaI��Һ��������ɫ������ | �����£�Ksp(AgCl)��Ksp(AgI) |
D | �����£���pH��ֽ��ã�0.1mol/LNa2SO3��ҺpHԼΪ10��0.1mol/LNaHSO3��ҺpHԼΪ5 | HSO3�����H+��������SO32������ |
A. A B. B C. C D. D