题目内容
【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+ 。利用该废液制备过二硫酸铵[( NH4) 2S2O8]和TiO2的一种工艺流程如下:

已知:i.TiOSO4在热水中易水解生成H2TiO3,相关离子形成氢氧化物沉淀的pH范围如 下表:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 时,Fe2+部分生成 Fe( Ⅱ)氨络离Fe(NH3)2]2+o
请回答下列问题:
(1)加入适量Fe的作用是________________ .
(2)生成TiO(OH)2的化学方程式为_______________ 。
(3)滤渣I、滤渣II均含有的物质的化学式为_____________ .
(4)加入H2O2的目的是除掉Fe( Ⅱ)氨络离子[Fe(NH3)2]2+,此过程中氧化剂与还原剂的物质的量之比理论上等于________ (填数值)。
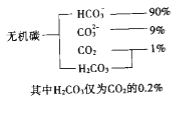
(5)常温下,含硫微粒主要存在形式与pH的关系如下图所示。

用Pt电极电解饱和NH4HSO4溶液制备过二硫酸铵时,为满足在阳极放电的离子主要为 HSO4-,应调节阳极区溶液的pH范围在______之间,其电极反应式为____________ 。
(6)科研人员常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定TiO2的纯度,其步骤为: 用足量酸溶解wg 二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取 25.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+。
①判断滴定终点的方法:________________________ 。
②滴定终点时消耗c mol/L-1 NH4Fe(SO4)2溶液VmL,则TiO2纯度为___________(写岀相关字母表示的代数式)。
【答案】将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀 TiOSO4+2NH3H2O = TiO(OH)2↓+ (NH4)2SO4 Fe(OH)3 1 : 2 0~2 2HSO4- -2e- = S2O82 - + 2H+ 当滴入最后一滴硫酸铁铵溶液时,溶液变为血红色且30s内不恢复原色 32cv/w%
【解析】
废酸中主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+,根据流程图,用氨水调节pH=3得到TiO(OH)2,而此时铁离子也会形成沉淀,因此需要加铁粉将铁离子转化为亚铁离子;滤液中加入氨水调节pH=10,得到的沉淀有氢氧化亚铁和氢氧化铝(滤渣I);滤液中含有部分Fe(II)氨络离子[Fe(NH3)2]2+,因此加入双氧水将亚铁离子氧化形成氢氧化铁沉淀(滤渣II);再在滤液中加入硫酸酸化后电解得到过二硫酸铵[(NH4)2S2O8]。据此分析解答。
(1)根据上述分析,铁粉主要作用是将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀,故答案为:将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀;
(2)根据流程图,用氨水调节pH=3,TiO2+生成TiO(OH)2,所以化学方程式为:TiOSO4+2NH3H2O = TiO(OH)2↓+ (NH4)2SO4,答案:TiOSO4+2NH3H2O = TiO(OH)2↓+ (NH4)2SO4;
(3)滤渣I为氢氧化亚铁和氢氧化铝,部分氢氧化亚铁氧化为氢氧化铁,滤渣II为氢氧化铁沉淀,因此滤渣I、滤渣II均含有的物质的化学式为Fe(OH)3,故答案为:Fe(OH)3;
(4)在碱性溶液中,加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+得到氢氧化铁沉淀,根据化合价升降守恒,配平后的离子方程式为2[Fe(NH3)2]2++4OH-+4H2O+H2O2=2Fe(OH)3↓+4NH3·H2O,氧化剂为H2O2,还原剂为[Fe(NH3)2]2+,氧化剂与还原剂的物质的量之比理论上等于1:2,故答案为:1:2;
(5)根据常温下,含硫微粒主要存在形式与 pH的关系图,阳极放电的离子主要是HSO4-,则阳极区电解质溶液的pH范围应控制在0~2,阳极发生氧化反应,HSO4-放电转化为S2O82-,则阳极的电极反应为:2HSO4--2e-═S2O82-+2H+,故答案为:0~2;2HSO4--2e-═S2O82-+2H+;
(6)①铁离子过量时,反应结束,故终点现象为:当滴入最后一滴硫酸铁铵时,溶液变成血红色,且30s内不变回原色;答案:当滴入最后一滴硫酸铁铵溶液时,溶液变为血红色且30s内不恢复原色;
②由TiO2~Fe3+关系式,n(TiO2)=n(Fe3+)=cmol· L-1×V×10-3L×100mL/25mL=4cV×10-3mol,TiO2纯度为4cV×10-3mol×80g·mol-1/w×100%=32cv/w%,故答案为:32cv/w%。

【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3的电子式为___。
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:
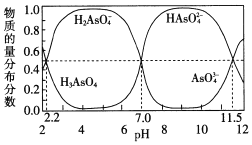
①lgKa1(H3AsO4)=_____。
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为___。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s)![]() 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1
反应Ⅱ.As2O3(g)+3C(s)![]()
![]() As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
反应Ⅲ.As4(g)![]() 4As(g) △H
4As(g) △H
①△H=____kJ·mol-1(用含a、b的代数式表示)。
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
反应Ⅱ | 反应Ⅲ | ||
活化能(kJ·mol-1) | 催化剂X | 56 | 75 |
催化剂Y | 37 | 97 | |
由上表判断催化剂X____(填“优于”或“劣于”)Y,理由是_____。
(4)反应2As2S3(s)![]() 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
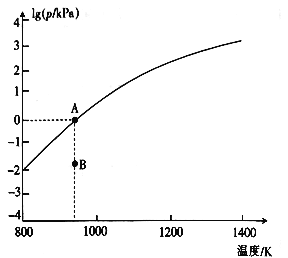
①对应温度下,B点的反应速率v(正)_____v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为____kPa,该反应的Kp=_____kPa5(Kp为以分压表示的平衡常数)。