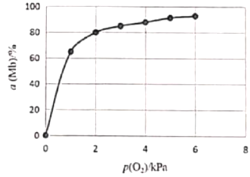
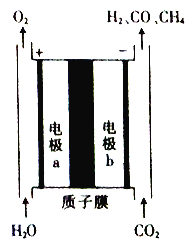
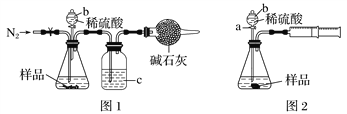
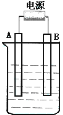
题目内容
【题目】高磷鲕状赤铁矿(主要含有![]() 、少量
、少量![]() 、CaO,
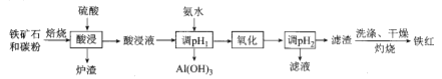
、CaO,![]() 等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
A. 铁红可用于油漆、油墨、建筑物着色剂
B. 酸浸液遇![]() 溶液生成蓝色沉淀
溶液生成蓝色沉淀
C. 洗涤滤渣时要用玻璃棒不断搅拌
D. 氧化时选用的试剂可以是![]() 、NaClO溶液
、NaClO溶液
【答案】C
【解析】
高磷鲕状赤铁矿主要含有的![]() ,又称铁红,易溶于强酸,中强酸,外观为红棕色粉末。可用于油漆、油墨、橡胶等工业中,可作为催化剂,炼铁原料。在碳粉与铁矿石焙烧、硫酸酸浸后, 溶液中含有Fe2+、Al3+、Ca2+,而后利用氨水调节溶液pH约5.2-7,可使Al3+沉淀完全,而Fe2+、Ca2+不受影响。利用氧化剂将Fe2+氧化为Fe3+后,由于Fe3+沉降的pH为2.7-3.7,故此时Fe3+因水解成为氢氧化铁而沉降。通过对滤渣洗涤、干燥、灼烧可得氧化铁。
,又称铁红,易溶于强酸,中强酸,外观为红棕色粉末。可用于油漆、油墨、橡胶等工业中,可作为催化剂,炼铁原料。在碳粉与铁矿石焙烧、硫酸酸浸后, 溶液中含有Fe2+、Al3+、Ca2+,而后利用氨水调节溶液pH约5.2-7,可使Al3+沉淀完全,而Fe2+、Ca2+不受影响。利用氧化剂将Fe2+氧化为Fe3+后,由于Fe3+沉降的pH为2.7-3.7,故此时Fe3+因水解成为氢氧化铁而沉降。通过对滤渣洗涤、干燥、灼烧可得氧化铁。
A. 铁红的主要成分是氧化铁,为红棕色,可用于油漆、油墨、建筑物的着色剂,A项正确;
B. 酸浸液中含有Fe2+,遇![]() 溶液生成蓝色的沉淀
溶液生成蓝色的沉淀![]() , B项正确;
, B项正确;
C. 用玻璃棒不断搅拌会破坏氢氧化铁,使一部分氢氧化铁溶解,降低产率,C项错误;
D. 氧化Fe2+时可选用![]() 、NaClO溶液作为氧化剂,将Fe2+氧化为Fe3+。反应原理分别为:2Fe2+ +H2O2+2H+=2Fe3+ +2H2O ,2Fe2++ ClO -+ 2H+ = 2Fe3+ + Cl- + H2O,D项正确;
、NaClO溶液作为氧化剂,将Fe2+氧化为Fe3+。反应原理分别为:2Fe2+ +H2O2+2H+=2Fe3+ +2H2O ,2Fe2++ ClO -+ 2H+ = 2Fe3+ + Cl- + H2O,D项正确;
答案选C。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3的电子式为___。
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:
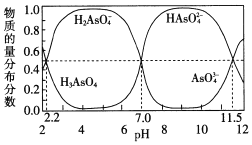
①lgKa1(H3AsO4)=_____。
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为___。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s)![]() 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1
反应Ⅱ.As2O3(g)+3C(s)![]()
![]() As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
反应Ⅲ.As4(g)![]() 4As(g) △H
4As(g) △H
①△H=____kJ·mol-1(用含a、b的代数式表示)。
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
反应Ⅱ | 反应Ⅲ | ||
活化能(kJ·mol-1) | 催化剂X | 56 | 75 |
催化剂Y | 37 | 97 | |
由上表判断催化剂X____(填“优于”或“劣于”)Y,理由是_____。
(4)反应2As2S3(s)![]() 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
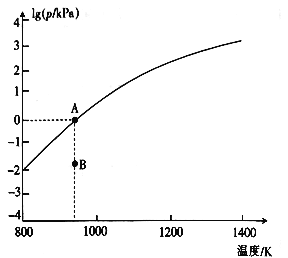
①对应温度下,B点的反应速率v(正)_____v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为____kPa,该反应的Kp=_____kPa5(Kp为以分压表示的平衡常数)。