题目内容
【题目】化合物H是用于治疗帕金森病的药物,名称为匹莫范色林,一种合成路线如图所示:
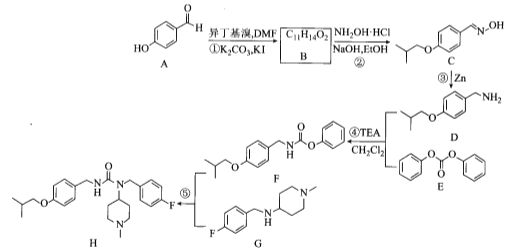
请回答下列问题:
(1)A的化学名称为_____________。
(2)B的结构简式为____________。
(3)D中官能团的名称是__________。
(4)③、⑤的反应类型分别为________、________。
(5)反应④的化学方程式为______________。
(6)芳香化合物X是E的同分异构体,X中含有两个苯环,能与FeCl3溶液发生显色反应也能发生银镜反应,其核磁共振氢谱显示有6种不同化学环境的氢,符合条件的X有:___种,写出其中一种的结构简式:________。
(7)已知: 。参考上述合成路线和信息,设计以化合物A和溴乙烷,乙醇为原料(无机试剂任选).制备
。参考上述合成路线和信息,设计以化合物A和溴乙烷,乙醇为原料(无机试剂任选).制备 的合成路线:______。
的合成路线:______。
【答案】4-羟基苯甲醛(或对羟基苯甲醛) 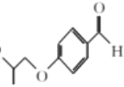 醚键、氨基 还原反应 取代反应
醚键、氨基 还原反应 取代反应 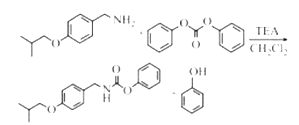 6
6 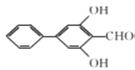 或
或 (其他合理答案也可以给分)
(其他合理答案也可以给分) 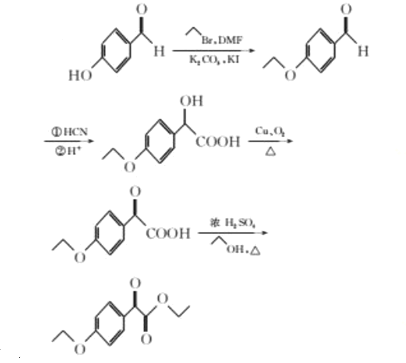
【解析】
有机物A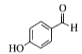 通过与卤代烃在一定条件下生成了醚
通过与卤代烃在一定条件下生成了醚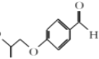 ,再与
,再与![]() 反应生成C物质
反应生成C物质 ,该物质在Zn的作用下发生还原反应可以得到D物质
,该物质在Zn的作用下发生还原反应可以得到D物质![]() ,D物质
,D物质![]() 与E物质
与E物质![]() 通过取代反应生成F
通过取代反应生成F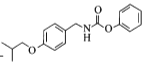 ,F物质
,F物质 与G物质
与G物质 通过再一次取代反应生成目标产物H
通过再一次取代反应生成目标产物H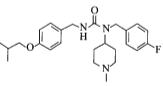 ,以此推断解题。
,以此推断解题。
(1).从A物质的结构简式 可看出该物质含有酚羟基和醛基,可将醛基和苯环作为母链,将羟基进行编号,可命名为4-羟基苯甲醛或根据习惯命名法将该物质命名为对羟基苯甲醛,故答案为4-羟基苯甲醛(或对羟基苯甲醛);
可看出该物质含有酚羟基和醛基,可将醛基和苯环作为母链,将羟基进行编号,可命名为4-羟基苯甲醛或根据习惯命名法将该物质命名为对羟基苯甲醛,故答案为4-羟基苯甲醛(或对羟基苯甲醛);
(2).通过对比A物质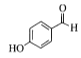 与C物质
与C物质 结构上的变化,可发现第一步和第二步反应主要改变的是苯环上所连的支链
结构上的变化,可发现第一步和第二步反应主要改变的是苯环上所连的支链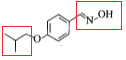 。结合B的分子式,可知由A到B的反应中增加了三个碳原子,由此可推断出B物质的结构简式为
。结合B的分子式,可知由A到B的反应中增加了三个碳原子,由此可推断出B物质的结构简式为 ,故答案为
,故答案为  ;
;
(3). 从该物质的结构简式![]() 可看出该物质含有两种官能团
可看出该物质含有两种官能团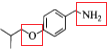 分别为醚键(C-O-C)、氨基(-NH/span>2),故答案为醚键、氨基;
分别为醚键(C-O-C)、氨基(-NH/span>2),故答案为醚键、氨基;
(4). 反应③中C物质的结构 变为D物质的结构
变为D物质的结构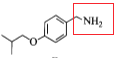 ,在该反应中氧原子个数减少,氢原子个数增加,该反应类型为还原反应;反应⑤中产物H是由F物质的红框部分
,在该反应中氧原子个数减少,氢原子个数增加,该反应类型为还原反应;反应⑤中产物H是由F物质的红框部分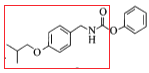 与G物质的红框部分
与G物质的红框部分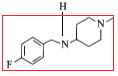 所构成的,结合该反应“代换”的特点,可判断出该反应类型为取代反应,故答案为还原反应、取代反应。
所构成的,结合该反应“代换”的特点,可判断出该反应类型为取代反应,故答案为还原反应、取代反应。
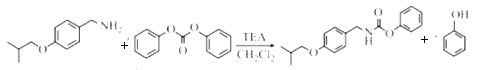
(5).从反应④的主要目标产物结构式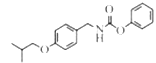 ,可看出分别是由两种反应物
,可看出分别是由两种反应物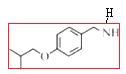 与
与 红框部分合成目标产物,同时剩下的部分组合成苯酚,故该反应的方程式为:
红框部分合成目标产物,同时剩下的部分组合成苯酚,故该反应的方程式为:
 ;
;
(6). 芳香化合物X是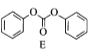 的同分异构体,X中含有两个苯环,能与FeCl3溶液发生显色反应,说明含有酚羟基;能发生银镜反应,说明含有醛基,不能确定结构的只有一个氧原子。又因其核磁共振氢谱显示有6种不同化学环境的氢,说明其同分异构体具有很强的对称性,故符合条件的X结构简式为
的同分异构体,X中含有两个苯环,能与FeCl3溶液发生显色反应,说明含有酚羟基;能发生银镜反应,说明含有醛基,不能确定结构的只有一个氧原子。又因其核磁共振氢谱显示有6种不同化学环境的氢,说明其同分异构体具有很强的对称性,故符合条件的X结构简式为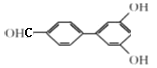 、
、 、
、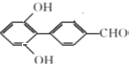 、
、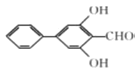 、
、![]() 、
、![]() 共6种,可写出其中任一种的结构简式。故答案为6 、
共6种,可写出其中任一种的结构简式。故答案为6 、 或
或![]() ;
;
(7). 以化合物 和溴乙烷,乙醇为原料制备
和溴乙烷,乙醇为原料制备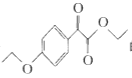 时,可观察出可利用反应①的方法合成醚键结构,再利用与HCN发生加成反应增长含有醛基一侧的支链,通过催化氧化将醇羟基氧化为羰基,最后再与乙醇发生酯化反应来合成最终产物。具体合成路线为:
时,可观察出可利用反应①的方法合成醚键结构,再利用与HCN发生加成反应增长含有醛基一侧的支链,通过催化氧化将醇羟基氧化为羰基,最后再与乙醇发生酯化反应来合成最终产物。具体合成路线为:
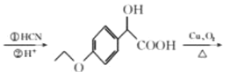
 。
。

 阅读快车系列答案
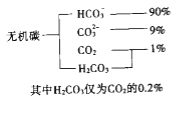
阅读快车系列答案【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3的电子式为___。
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:

①lgKa1(H3AsO4)=_____。
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为___。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s)![]() 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1
反应Ⅱ.As2O3(g)+3C(s)![]()
![]() As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
反应Ⅲ.As4(g)![]() 4As(g) △H
4As(g) △H
①△H=____kJ·mol-1(用含a、b的代数式表示)。
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
反应Ⅱ | 反应Ⅲ | ||
活化能(kJ·mol-1) | 催化剂X | 56 | 75 |
催化剂Y | 37 | 97 | |
由上表判断催化剂X____(填“优于”或“劣于”)Y,理由是_____。
(4)反应2As2S3(s)![]() 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正)_____v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为____kPa,该反应的Kp=_____kPa5(Kp为以分压表示的平衡常数)。
【题目】实验室测定水体中氯离子含量,实验过程如下:向水样中加入K2CrO4溶液作指示剂,用0.0010 mol·L-1AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管。
(2)滴定达到终点的标志是___________________________________________。
(3)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(4)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________ mol·L-1。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(5)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥 B.滴定前,未使用标准液润洗滴定管
C.滴定管滴定前仰视读数,滴定后俯视读数
D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡