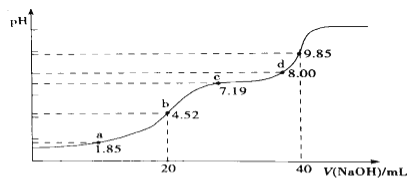
题目内容
【题目】下表中的实验操作不能达到实验目的或得出相应结论的是
选项 | 实验操作 | 实验目的或结论 |
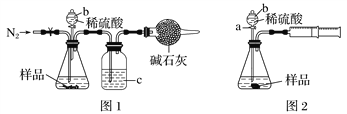
A | 向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,完全反应后收集H2的体积 | 比较两种酸的电离程度 |
B | 将混有Ca(OH)2杂质的 Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀。 | 除去Mg(OH)2样品中的Ca(OH)2杂质 |
C | 向盛有1mL0.01mol/LAgNO3溶液的试管中滴加5滴0.01mol/L NaCl溶液,有白色沉淀生成,再滴加0.01mol/L NaI溶液,产生黄色沉淀。 | 常温下,Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5 | HSO3-结合H+的能力比SO32-的弱 |
A. A B. B C. C D. D
【答案】C
【解析】
A. 同pH、同体积的醋酸和盐酸溶液中,氢离子的物质的量浓度相同,加入足量镁粉,电离度大的酸最终产生H2的体积少于电离程度小的酸,所以可以通过收集到氢气的体积多少,比较两种酸的电离程度,故A能达到式样目的;
B.将混有Ca(OH)2杂质的 Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,相当于增大了c(Mg2+), Mg(OH)2的沉淀溶解平衡向沉淀的方向移动,使Mg(OH)2沉淀,从而达到除去Mg(OH)2样品中的Ca(OH)2的目的,故B能达到实验目的;
C.向盛有1mL0.01mol/LAgNO3溶液的试管中滴加5滴0.01mol/L NaCl溶液,有白色沉淀生成,再滴加0.01mol/LNaI溶液,产生黄色沉淀,由于AgNO3过量,所以得到AgCl沉淀和AgI沉淀,不发生沉淀转的转化,故C不能达到实验目的;
D.阴离子水解程度越大,溶液pH越大,说明越易结合氢离子,亚硫酸钠溶液的pH较大,而NaHSO3溶液pH约为5,是HSO3-电离的结果,则![]() 结合
结合![]() 的能力比
的能力比![]() 的弱,故D结论正确;
的弱,故D结论正确;
本题答案为C。

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3的电子式为___。
(2)改变0.1mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO4-、HAsO42-及AsO43-的物质的量分布分数随pH的变化如图所示:
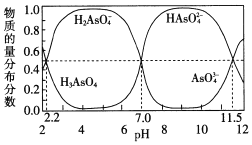
①lgKa1(H3AsO4)=_____。
②用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为___。
(3)焦炭真空冶炼砷时需加入催化剂,其中部分热化学反应如下:
反应Ⅰ.As2O3(g)+3C(s)![]() 2As(g)+3CO(g) △H1=akJ·mol-1
2As(g)+3CO(g) △H1=akJ·mol-1
反应Ⅱ.As2O3(g)+3C(s)![]()
![]() As4(g)+3CO(g) △H2=bkJ·mol-1
As4(g)+3CO(g) △H2=bkJ·mol-1
反应Ⅲ.As4(g)![]() 4As(g) △H
4As(g) △H
①△H=____kJ·mol-1(用含a、b的代数式表示)。
②反应中催化剂的活性会因为发生反应Ⅱ(生成As4)而降低,同时存在的反应Ⅲ使As4量减少。相关数据如下表:
反应Ⅱ | 反应Ⅲ | ||
活化能(kJ·mol-1) | 催化剂X | 56 | 75 |
催化剂Y | 37 | 97 | |
由上表判断催化剂X____(填“优于”或“劣于”)Y,理由是_____。
(4)反应2As2S3(s)![]() 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
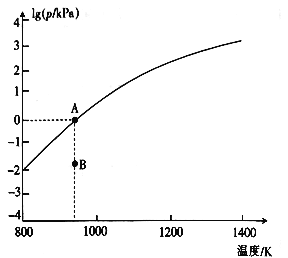
①对应温度下,B点的反应速率v(正)_____v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为____kPa,该反应的Kp=_____kPa5(Kp为以分压表示的平衡常数)。
【题目】实验室测定水体中氯离子含量,实验过程如下:向水样中加入K2CrO4溶液作指示剂,用0.0010 mol·L-1AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管。
(2)滴定达到终点的标志是___________________________________________。
(3)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(4)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________ mol·L-1。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(5)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥 B.滴定前,未使用标准液润洗滴定管
C.滴定管滴定前仰视读数,滴定后俯视读数
D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡