题目内容
5.下表是元素周期表中的一部分,表中字母分别表示一种元素,请回答下列问题:
(1)n元素在周期表中的位置是第四周期IVB族,非金属性最强的元素是F(填化学式).单质中金属性最强的是钠(填名称).
(2)上述元素中最高价氧化物对应水化物的酸性最强的是(用化学式表示)HClO4.
(3)c、d、f三种元素的原子半径由小到大的顺序是Na>N>O(用元素符号表示).
(4)h与d形成的化合物中含有的化学键是共价键,写出h单质的一种重要用途半导体材料.
(5)在c、d、k、m四种元素中下列说法正确的是CD(填写序号).
A.原子半径m>k>d>c
B.最高价氧化物对应水化物的酸性k>m>c
C.四种元素的单质中k的熔沸点最高
D.m的单质能与水反应,生成一种具有漂白性的物质
(6)元素c的气态氢化物与其最高价氧化物的水化物反应生成的物质为NH4NO3(用化学式表示),该物质所含化学键类型为离子键、共价键,属于离子化合物(填“离子”或“共价”)
(7)从g、d形成的化合物与h、d形成的化合物的混合物中,分离提纯h、d形成的化合物,可加入上述H、Cl(用元素符号表示)两种元素形成的化合物的水溶液后再过滤洗涤.
(8)写出实验室制备c的气态氢化物的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;△\;}}{\;}$CaCl2+2NH3↑+2H2O.
分析 由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为F、f为Na、g为Al、h为Si、k为S、m为Cl、n为Ti.
(1)由n元素在周期表中的位置,可知其位于第四周期IVB族;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强;
(2)上述元素中最高价氧化物对应水化物的酸性最强的是高氯酸;
(3)同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(4)h与d形成的化合物为SiO2,属于原子晶体,Si单质是良好的半导体材料;
(5)A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.非金属性越强,最高价氧化物对应水化物的酸性越强;
C.四种元素的单质中,常温下k为固体,其它三种为气体;
D.氯气与水反应生成HCl与HClO,HClO具有漂白性;
(6)元素c的气态氢化物与其最高价氧化物的水化物反应生成的物质为硝酸铵;
(7)g、d形成的化合物为Al2O3,h、d形成的化合物为SiO2,氧化铝能与盐酸反应,而二氧化硅不能,可以用HCl水溶液进行分离提纯二氧化硅;
(8)实验室用氯化铵与氢氧化钙制备氨气,反应生成氯化钙、氨气与水.
解答 解:由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为F、f为Na、g为Al、h为Si、k为S、m为Cl、n为Ti.
(1)由n元素在周期表中的位置,可知其位于第四周期IVB族;同周期自左而右非金属性增强、金属性减弱,同主族自上而下非金属性减弱、金属性增强,故上述元素中,非金属性最强的元素是F,单质中金属性最强的是钠,故答案为:第四周期IVB族;F;钠;
(2)上述元素中最高价氧化物对应水化物的酸性最强的是HClO4,故答案为:HClO4;
(3)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径::Na>N>O,故答案为:Na>N>O;
(4)h与d形成的化合物为SiO2,属于原子晶体,含有共价键,Si单质是良好的半导体材料,故答案为:共价键;半导体材料;
(5)A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:k>m>c>d,故A错误;
B.非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:高氯酸>硫酸,故B错误;
C.四种元素的单质中,常温下k为固体,其它三种为气体,单质中k的熔沸点最高,故C正确;
D.氯气与水反应生成HCl与HClO,HClO具有漂白性,故D正确,
故选:CD;
(6)元素c的气态氢化物与其最高价氧化物的水化物反应生成的物质为NH4NO3,含有离子键、共价键,属于离子化合物,故答案为:NH4NO3;离子键、共价键;离子;
(7)g、d形成的化合物为Al2O3,h、d形成的化合物为SiO2,氧化铝能与盐酸反应,而二氧化硅不能,从二者混合物中分离提纯SiO2,可加入上述H、Cl两种元素形成的化合物的水溶液后再过滤洗涤,故答案为:H、Cl;
(8)实验室用氯化铵与氢氧化钙制备氨气,反应生成氯化钙、氨气与水,反应方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;△\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;△\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查元素周期表与元素周期律综合应用,需要学生熟练掌握基础上,难度不大.

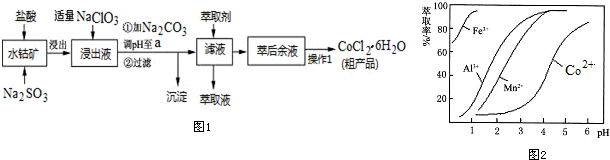
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5.

| A. | 原子半径大小比较为A>B>C>D | B. | 生成的氢化物稳定性为A>B>C>D | ||
| C. | A与C形成的阴离子可能有AC${\;}_{3}^{2-}$ | D. | A、B、C、D的单质常温下均不导电 |
| A. | 1 L 0.1 mol/L醋酸 | B. | 0.1 L 0.1 mol/L H3PO4溶液 | ||
| C. | 0.5 L 0.1 mol/L盐酸 | D. | 2 L 0.1 mol/L H2SO3溶液 |
| A. | 标准状况下,1L乙醇完全燃烧产生CO2分子的数目为$\frac{{N}_{A}}{22.4}$×2 | |
| B. | 磷酸的摩尔质量与NA个磷酸分子的质量之和相等 | |
| C. | 16gO2、O3的混合物所含的氧原子数目为NA | |
| D. | 1molOH-所含的质子数为10NA |

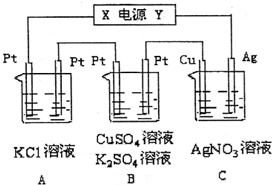 如图所示,若电解5min时,铜电极质量增加2.16g.试回答:
如图所示,若电解5min时,铜电极质量增加2.16g.试回答: 分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化:
分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化: .
.