题目内容
12.NA代表阿伏伽德罗常数,下列说法正确的是( )| A. | 标准状况下,1L乙醇完全燃烧产生CO2分子的数目为$\frac{{N}_{A}}{22.4}$×2 | |
| B. | 磷酸的摩尔质量与NA个磷酸分子的质量之和相等 | |
| C. | 16gO2、O3的混合物所含的氧原子数目为NA | |
| D. | 1molOH-所含的质子数为10NA |
分析 A、标况下,乙醇为液态;
B、摩尔质量的单位为g/mol;
C、氧气和臭氧均由氧原子构成;
D、氢氧根中含9个质子.
解答 解:A、标况下,乙醇为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、摩尔质量的单位为g/mol,故磷酸的摩尔质量为98g/mol,而NA个磷酸分子的质量为98g,故B错误;
C、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,个数为NA个,故C正确;
D、氢氧根中含9个质子,故1mol氢氧根中含9NA个质子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
3.下列溶液中的氯离子数目、浓度与50mL 1mol•L-1的FeCl3溶液中氯离子数目、浓度相等的是( )
| A. | 50mL 1.5mol•L-1的CaCl2溶液 | B. | 100mL 3mol•L-1的NH4Cl溶液 | ||
| C. | 75mL 3mol•L-1的KCl溶液 | D. | 50mL 2mol•L-1的FeCl2溶液 |
7.下列变化中,必须加入氧化剂的才能实现的是( )
| A. | Na2O→NaOH | B. | H2SO4→H2 | C. | CuO→CuSO4 | D. | CO→CO2 |
17.下列有关实验的叙述正确的是( )
| A. | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝,则原溶液中无NH4+ | |
| B. | 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| C. | 光照氯水有气泡冒出,该气体为Cl2 | |
| D. | 用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出 |
4.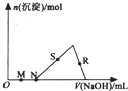 向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
 向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )| A. | M点对应的溶液中:K+、Fe2+、SO42-、NO3- | |
| B. | N点对应的溶液中:K+、NH4+、Cl-、CO32- | |
| C. | S点对应的溶液中:Na+、SO42-、HCO3-、NO3- | |
| D. | R点对应的溶液中:Na+、SO42-、Cl-、NO3- |
1.下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离氢氧化铁胶体和氯离子 | 过滤 | 胶体不能透过半透膜,离子能 |
| B | 除去乙醇中的乙酸 | 蒸馏 | 先加生石灰,利用乙醇与乙酸盐沸点相差较大 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离植物油和水的混合物 | 分液 | 二者互不相溶且沸点不同 |
| A. | A | B. | B | C. | C | D. | D |
1.小明家里收藏了一件清代的铝制佛像,该佛像至今仍保存十分完好.该佛像未锈蚀的主要原因是( )
| A. | 铝易氧化,但氧化铝具有保护内部铝的作用 | |
| B. | 铝的氧化物容易发生还原反应 | |
| C. | 铝不易被氧化 | |
| D. | 铝不易发生化学反应 |

