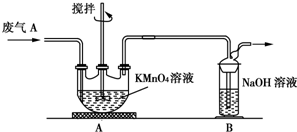
题目内容
11.下列溶液中导电性最强的是( )| A. | 1 L 0.1 mol/L醋酸 | B. | 0.1 L 0.1 mol/L H3PO4溶液 | ||
| C. | 0.5 L 0.1 mol/L盐酸 | D. | 2 L 0.1 mol/L H2SO3溶液 |
分析 溶液的导电性取决于溶液离子浓度大小,离子浓度越大,则导电性越强,以此解答.
解答 解:A、醋酸为弱电解质,不能完全离子,溶液中阴阳离子总浓度小于0.2moL/L;
B、H3PO4不能完全电离,第一步为主,则阴阳离子总浓度小于0.2mol/L;
C、0.1mol/L 盐酸中阴阳离子总浓度等于0.2mol/L;
D、亚硫酸是弱酸,不能完全电离,分步电离、以第一步为主,0.1mol/LH2SO3溶液中阴阳离子总浓度小于0.2mol/L,
则离子浓度最大的为C,导电性应最强,
故选C.
点评 本题考查电解质溶液的导电性强弱的比较,难度不大,注意把握电解质的强弱以及溶液总离子浓度的大小比较.

练习册系列答案
相关题目
4.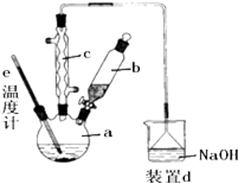 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴.回答下列问题:
①装置c为球形冷凝管,冷凝水的水流方向为下进上出(填“上进下出”或“下进上出”).
②写出在a中发生的化学反应方程式2Fe+3Br2=2FeBr3、、C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
③装置d中NaOH溶液的作用是吸收HBr和Br2.
(2)液溴滴完后,经过下列步骤分离提纯:
Ⅰ向a中加入10mL水,然后过滤除去未反应的铁屑;
Ⅱ滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.
Ⅲ向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
回答下列问题:
①纯溴苯为无色油状液体,而a中得到的粗产品呈褐色,则粗产品中溶解的主要杂质是Br2(填化学式).
②用10%的NaOH溶液洗涤的目的是除去溴苯中溶解的杂质,该杂质为Br2(填化学式).
③加入氯化钙的目的是干燥.
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母).
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶[来 | 微溶 |
①装置c为球形冷凝管,冷凝水的水流方向为下进上出(填“上进下出”或“下进上出”).
②写出在a中发生的化学反应方程式2Fe+3Br2=2FeBr3、、C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
③装置d中NaOH溶液的作用是吸收HBr和Br2.
(2)液溴滴完后,经过下列步骤分离提纯:
Ⅰ向a中加入10mL水,然后过滤除去未反应的铁屑;
Ⅱ滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.
Ⅲ向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
回答下列问题:
①纯溴苯为无色油状液体,而a中得到的粗产品呈褐色,则粗产品中溶解的主要杂质是Br2(填化学式).
②用10%的NaOH溶液洗涤的目的是除去溴苯中溶解的杂质,该杂质为Br2(填化学式).
③加入氯化钙的目的是干燥.
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母).
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
6.在一定条件下,反应:2NO+O2?2ΝΟ2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是( )
①混合气体的总分子数不再变化
②混合气体的颜色不再变化
③容器的总压强不再变化
④混合气体的总质量不再变化
⑤混合气体的密度不再变化
⑥单位时间内生成nmol的NO,同时消耗nmol的NO2.
①混合气体的总分子数不再变化
②混合气体的颜色不再变化
③容器的总压强不再变化
④混合气体的总质量不再变化
⑤混合气体的密度不再变化
⑥单位时间内生成nmol的NO,同时消耗nmol的NO2.
| A. | ①②③ | B. | ④⑤⑥ | C. | ①②④ | D. | ③⑤⑥ |
3.下列溶液中的氯离子数目、浓度与50mL 1mol•L-1的FeCl3溶液中氯离子数目、浓度相等的是( )
| A. | 50mL 1.5mol•L-1的CaCl2溶液 | B. | 100mL 3mol•L-1的NH4Cl溶液 | ||
| C. | 75mL 3mol•L-1的KCl溶液 | D. | 50mL 2mol•L-1的FeCl2溶液 |
1.下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离氢氧化铁胶体和氯离子 | 过滤 | 胶体不能透过半透膜,离子能 |
| B | 除去乙醇中的乙酸 | 蒸馏 | 先加生石灰,利用乙醇与乙酸盐沸点相差较大 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离植物油和水的混合物 | 分液 | 二者互不相溶且沸点不同 |
| A. | A | B. | B | C. | C | D. | D |