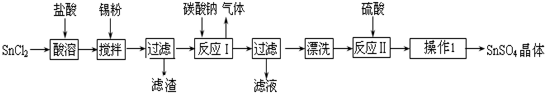
题目内容
10.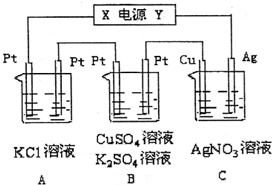 如图所示,若电解5min时,铜电极质量增加2.16g.试回答:
如图所示,若电解5min时,铜电极质量增加2.16g.试回答:(1)电源电极X名称为负极(填“正极”或“负极”).
(2)电解池中溶液的pH变化:B减小,C不变(填“增大”、“减小”或“不变”).
(3)B中阳极的电极反应式为4OH--4e-=2H2O+O2↑;若通电5min时B中共收集224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度约为0.025mol/L.
(4)A中发生反应的化学方程式为2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑,若A中KCl溶液的体积也是200mL,电解后溶液的pH=13.
(5)若将C装置单独取出,导线连接铜、银后,请写出负极的电极反应式Cu-2e-=Cu2+.
分析 (1)由铜电极的质量增加,则Cu电极为阴极,可知X为电源的负极;
(2)B中电解硫酸铜溶液生成硫酸,pH减小,根据C中电极反应判断;
(3)根据电极反应及电子守恒来计算;
(4)根据A中的电极反应及与C中转移的电子守恒来计算;
(5)若将C装置单独取出,导线连接铜、银后,构成原电池,金属铜为原电池的负极,发生失电子的氧化反应.
解答 解:(1)由铜电极的质量增加,发生Ag++e-═Ag,则Cu电极为阴极,可知X为电源的负极,故答案为:负极;
(2)B中电解硫酸铜溶液生成硫酸,溶液中氢离子浓度增大,pH减小,C中C中阴极反应为Ag++e-═Ag,阳极反应为Ag-e-═Ag+,溶液浓度不变,则pH不变,
故答案为:减小;不变;
(3)C中阴极反应为Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,则转移的电子为0.02mol,
B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,
则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=$\frac{0.005mol}{0.2L}$=0.025 mol•L-1;
故答案为:4OH--4e-═2H2O+O2↑;0.025 mol•L-1;
(4)由A中发生2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑~2e-,
由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,
则c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol•L-1,溶液pH=13,
故答案为:2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑;13;
(5)若将C装置单独取出,导线连接铜、银后,构成原电池,金属铜为原电池的负极,金属银是正极,发生金属铜和硝酸银之间的置换反应,负极的电极反应式为:Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+.
点评 本题考查电解原理,明确Cu电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,注意计算时电子守恒的应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下.
(3)请写出C装置中的离子反应方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(6)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇挥发、副反应发生或反应太剧烈
(7)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,其原因是乙烯和液溴均易溶于四氯化碳.
| A. | 容器中混合气体的质量不随时间变化 | |
| B. | 容器内三种气体 AB、A2、B2共存 | |
| C. | v正(AB)=2v逆(A2) | |
| D. | 单位时间内消耗n mol A2,同时生成2n mol AB |
| A. | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝,则原溶液中无NH4+ | |
| B. | 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| C. | 光照氯水有气泡冒出,该气体为Cl2 | |
| D. | 用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出 |